
【题目】下图是以Zn和Cu为电极,稀H2SO4为电解质溶液形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下:
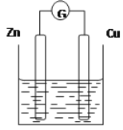
Date:2016.03.06 实验后的记录: ①Zn为阳极,Cu为阴极 ②H+向负极移动 ③电子流动方向Zn→Cu ④Cu极有H2产生 ⑤若有1mol电子流过导线,则产生H2为0.5mol ⑥正极的电极反应式:Zn―2e―=Zn2+ |
(1)在卡片上,叙述合理的是 (填序号)。
(2)在实验中,甲同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是 。
(3)如果把锌片换成石墨,发现电流计指针几乎不能偏转,原因是 。
(4)如果把硫酸换成硫酸铜溶液,猜测 (填“锌极”或“铜极”)变粗,原因是 (用电极方程式表示)。
【答案】(1)③④⑤(2分,错一个得1分,错两个该空不得分)
(2)Zn片不纯,在Zn片上就能形成许多微小原电池(1分)(写出Zn片不纯即得分)
(3)不存在能自发进行的氧化还原反应(1分)(写出不会形成原电池即得分)
(4)铜极 (1分) Cu2++2e-=Cu(2分)。
【解析】
试题分析:(1)①在该原电池反应中,Zn是负极,Cu是正极,错误;②根据同种电荷相互排斥,异种电荷相互吸引的原则,溶液中的H+向正极移动,错误;③电子由负极Zn经外电路流向正极Cu,正确;④溶液中的H+在正极Cu上获得电子变为氢气逸出,所以Cu极有H2,正确;⑤根据闭合回路中电子转移数目相对可知,若有1mol电子流过导线,则产生H2为0.5mol,正确;⑥Zn是负极,负极的电极反应式:Zn―2e―=Zn2+,错误。(2)在实验中,甲同学发现不仅在铜片上有气泡产生,而且在锌片上也产生了气体,分析原因可能是Zn片不纯,在Zn片上就能形成许多微小原电池。(3)如果把锌片换成石墨,发现电流计指针几乎不能偏转,原因是不存在能自发进行的氧化还原反应;(4)如果把硫酸换成硫酸铜溶液,锌为负极,失去电子,发生氧化反应,在正极上溶液的Cu2+获得电子变为单质Cu附着在电极上,使Cu电极变粗,用电极方程式表示Cu2++2e-=Cu。


科目:高中化学 来源: 题型:
【题目】同周期的X、Y、Z三种元素,已知其高价氧化物对应的水化物的酸性强弱顺序是:HXO4 >H2YO4>H3ZO4,则下列各判断中正确的是( )
A. 非金属性:X>Y>Z B. 原子半径:X>Y>Z
C. 气态氢化物稳定性:X<Y<Z D. 原子序数:X<Y<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修2:化学与技术]
海水占地球总储水量的97.2﹪。若把海水淡化和化工生产结合起来,既能解决淡水资源缺乏的问题,又能充分利用海洋资源。
下图是利用海水资源进行化工生产的部分工艺流程示意图:

(1)该工艺流程示意图中包含了 、 (填化学工业的名称)。
(2)在流程Ⅰ中,欲除去粗盐中含有的Ca2+、Mg2+、SO42+等离子,需将粗盐溶解后,按顺序加入药品进行沉淀、过滤等。加入药品和操作的顺序可以是 (填字母)。
A.Na2CO3、NaOH、 BaCl2、过滤、盐酸
B.NaOH、 BaCl2、 Na2CO3、过滤、盐酸
C.NaOH、 Na2CO3、 BaCl2、过滤、盐酸
D.BaCl2、Na2CO3、 NaOH、 过滤、盐酸
(3)流程Ⅱ中,通电开始后,阳极区产生的气体是 (填化学式),阴极附近溶液pH会 (填“增大”、“减小”或“不变”)。
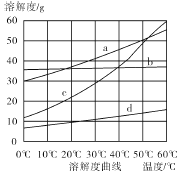
(4)流程Ⅲ中,通过相应化学反应可以得到NaHCO3晶体。下图为NaCl、NH4Cl、NaHCO3、NH4HCO3的溶解度曲线,其中能表示NaHCO3溶解度曲线的是 ,生成NaHCO3晶体的化学反应方程式是 。
(5)流程Ⅳ中,所得纯碱常含有少量可溶性杂质,常用的提纯方法是 (填名称),通过该法提纯后得到纯净的Na2CO3·10H2O,Na2CO3·10H2O脱水得到无水碳酸钠。
已知:Na2CO3·H2O(s)=Na2CO3(s)+H2O(g) ΔH1=+58.73kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ΔH2=+473.63 kJ·mol-1
把脱水过程产生的气态水完全液化释放的热能全部用于生产Na2CO3所需的能耗(不考虑能量损失),若生产1molNa2CO3需要耗能92.36kJ,由此得出:H2O(g)= H2O(l) △H= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若用乙烯和氯气在适当的条件下反应制取三氯乙烷,这一过程中所发生的反应的类型及消耗氯气的量是(设乙烯为1 mol,反应产物中的有机物只有三氯乙烷)
A.取代反应,4 mol Cl2
B.加成反应,2 mol Cl2
C.加成反应、取代反应,3 mol Cl2
D.加成反应、取代反应,2 mol Cl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、已知在稀溶液中,酸跟碱发生中和反应生成1mol水时的反应热叫做中和热。现利用下图装置进行中和热的测定,请回答下列问题:
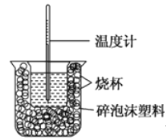
(1)该图中有两处未画出,它们分别是______、______。
(2)做一次完整的中和热测定实验,温度计需使用______次。
(3)把温度为13℃,浓度为1.0mol/L的酸溶液和1.1mol/L的碱溶液各50mL混合(溶液密度均为1g/mL),生成溶液的比热容c=4.184J/(g℃),轻轻搅动,测得酸碱混合液的温度变化数据如下:
反应物 | 起始温度t1/℃ | 终止温度t2/℃ | 中和热 |
HCl+NaOH | 13 | 19.8 | △H1 |
HCl+NH3H2O | 13 | 19.3 | △H2 |
①比较△H1和△H2的相对大小:△H1 △H2(填“>”“<”或“=”)。
②两组实验结果差异的原因是 。
③写出HCl和NH3H2O反应的热化学方程式: 。
II、如下图所示:用两张圆形滤纸分别折叠成漏斗状,套在一起,使四周都有四层。把内层滤纸取出,在底部剪一个小孔,用水润湿,再跟另一纸漏斗套在一起,架在铁圈上,下面放置一盛沙的蒸发皿。把5 g干燥的氧化铁粉末和2 g铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条。观察发生的现象。通过以上实验信息,回答下列问题:
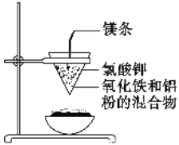
(1)写出该反应的化学方程式:__________,该反应称为________反应。
(2)选出该实验的实验现象(填写在横线上):________。
①镁条剧烈燃烧 ②放出大量的热,并发出耀眼的光芒,火星四射
③纸漏斗的下部被烧穿 ④有红热状态的液珠落入蒸发皿内的细沙上,液珠冷却后变为黑色固体
(3)写出各物质的作用:蒸发皿盛沙:________;镁条:________;氯酸钾:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活中的某些问题常常涉及化学知识,下列叙述错误的是
A.纯碱可用于制造玻璃,也可用于除去物品表面的油污
B.用聚氯乙烯代替木材生产包装盒、快餐盒等,以减少木材的使用
C.黄河人海口沙洲的形成和卤水点豆腐,都体现了胶体聚沉的性质
D.“煤改气”、“煤改电”等燃料改造工程有利于减少环境污染
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com