
 ,S2Cl2遇水易水解,在反应过程中硫元素一部分升高到+4价(生成SO2),一部分降低到0价(生成S),同时生成HCl,反应方程式为:2S2Cl2+2H2O=3S↓+SO2↑+4HCl,
,S2Cl2遇水易水解,在反应过程中硫元素一部分升高到+4价(生成SO2),一部分降低到0价(生成S),同时生成HCl,反应方程式为:2S2Cl2+2H2O=3S↓+SO2↑+4HCl, ;2S2Cl2+2H2O=3S↓+SO2↑+4HCl;
;2S2Cl2+2H2O=3S↓+SO2↑+4HCl;

 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案科目:高中化学 来源: 题型:
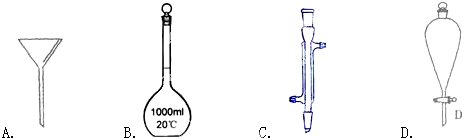
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应过程中,分子的种类和数目一定发生改变 |
| B、如果某化学反应的△H和△S均小于0,则反应一定能自发进行 |
| C、化学反应过程中,一定有化学键的断裂和形成 |
| D、放热反应的反应速率,一定比吸热反应的反应速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
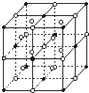 A、B、C、D是短周期元素,它们的离子具有相同的电子层结构,且半径依次减小.A与D的化合物X既能与盐酸反应,又能与NaOH溶液反应;B、C组成典型的离子化合物Y,其晶体结构类似于NaCl晶体;A与C以原子个数之比1:1组成化合物Z.
A、B、C、D是短周期元素,它们的离子具有相同的电子层结构,且半径依次减小.A与D的化合物X既能与盐酸反应,又能与NaOH溶液反应;B、C组成典型的离子化合物Y,其晶体结构类似于NaCl晶体;A与C以原子个数之比1:1组成化合物Z.查看答案和解析>>
科目:高中化学 来源: 题型:
| 粒子代码 | a | b | c | d | e | f | g |
| 原子核数 | 单核 | 单核 | 双核 | 多核 | 单核 | 多核 | 多核 |
| 电荷数(单位电荷) | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、Na+、NO3-、Cu2+ |
| B、Ba2+、Mg2+、Cl-、SO42- |
| C、Mg2+、K+、OH-、NO3- |
| D、NO3-、SO42-、K+、Mg2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定 次数 | 样品的质量/g | 稀盐酸的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.320 0 | 1.02 | 21.03 |
| 2 | 0.320 0 | 2.00 | 21.99 |
| 3 | 0.320 0 | 0.20 | 20.20 |
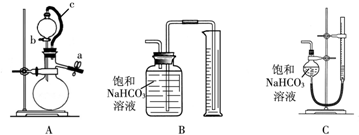
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com