


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、向100mL 0.1mol/L的FeSO4溶液中,加入0.01mol Na2O2固体2Fe2++2Na2O2+2H2O═4Na++2Fe(OH)2+O2↑ |
| B、向明矾溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ |
| C、在硫酸工业中,对尾气中的SO2用过量的氨水吸收的反应:NH3?H2O+SO2=NH4++HSO3- |
| D、向20mL 0.5mol/L FeBr2溶液中通入448mL Cl2(标准状况)2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2. |
查看答案和解析>>
科目:高中化学 来源: 题型:
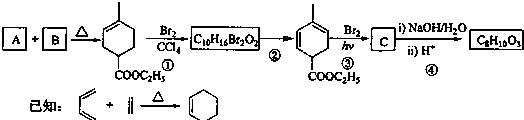
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
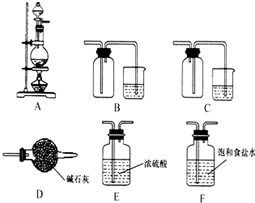 A、B、C、D、E均为短周期主族元素,其原子序数依次增大.其中A元素原子核内只有1个质子;A与C,B与D分别同主族; B、D两元素原子序数之和是A、C两元素原子序数之和的2倍.
A、B、C、D、E均为短周期主族元素,其原子序数依次增大.其中A元素原子核内只有1个质子;A与C,B与D分别同主族; B、D两元素原子序数之和是A、C两元素原子序数之和的2倍.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
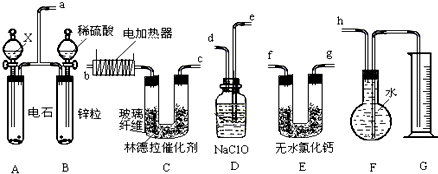
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水 | B、氯化钙溶液 |
| C、氢氧化钠溶液 | D、稀硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com