
| A. | 向硫酸铝溶液中滴加过量的氨水:Al3++4OH?═AlO2?+2H2O | |
| B. | 金属铜与浓硝酸反应:3Cu+8H++2NO3?═3Cu2++2NO↑+4H2O | |
| C. | 实验室用浓盐酸与MnO2反应制Cl2:MnO2+2H++2Cl?$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++H2O | |
| D. | 向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
分析 A.氨水为弱碱,二者反应生成氢氧化铝沉淀;
B.铜与浓硝酸反应生成的是二氧化氮气体;
C.离子方程式两边总电荷不相等,违反了电荷守恒;
D.偏铝酸钠与过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠.
解答 解:A.硫酸铝与氨水反应生成硫酸铵和氢氧化铝沉淀,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故A错误;
B.金属铜与浓硝酸反应生成硝酸铜、二氧化氮气体和水,正确的离子方程式为:Cu+4H++2NO3?═Cu2++2NO2↑+2H2O,故B错误;
C.实验室用浓盐酸与MnO2反应制Cl2,正确的离子方程式为:MnO2+4H++2Cl?$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+Mn2++2H2O,故C错误;
D.NaAlO2溶液中通入过量CO2,反应的离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故D正确;
故选D.
点评 本题考查了离子方程式的正误判断,为中等难度的试题,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | S原子的结构示意图: | |
| B. | 氯化钠的电子式: | |
| C. | 乙醇的结构式: | |
| D. | 硫酸的电离方程式:HSO4=H2++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
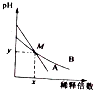 室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示,下列说法正确的是( )
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示,下列说法正确的是( )| A. | 稀释前,c(A)=10c(B) | |
| B. | 在M点,A、B两种碱溶液中阳离子的物质的量浓度相等 | |
| C. | 稀释前,A溶液中由水电离出的OH-的浓度大于10-7mol/L | |
| D. | 由图可知,A为强碱,B为弱碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L CH4中含有的氢原子数为2NA | |
| B. | 11.2 L CO2与8.5 g NH3所含分子数相等 | |
| C. | 常温下,2.7g铝与足量的盐酸反应,失去的电子数为0.3NA | |
| D. | 常温下,1L 0.1mol/L MgCl2溶液中含Cl- 数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 做金属钠与水反应实验时,剩余的钠不能再放入原试剂瓶 | |
| B. | 酸式滴定管装标准液前,必须先用该溶液润洗 | |
| C. | 锥形瓶用作反应容器时一定不能加热 | |
| D. | 用容量瓶配溶液时,若加水超过刻度线,立即用滴定管吸出多余液体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com