
【题目】下列物质均为常见物质或它们的溶液,其中 A为淡黄色固体, C、X 均为无色气体,Z为浅绿色溶液,D为一种常见的强碱。根据它们之间的转化关系(下图),回答下列问题: (部分反应物与产物已省略)

(1)写出下列物质的化学式: A______B________ D________
(2)A 与 SO3(g)的反应类似于 A 与 X 的反应,请写出 A 与 SO3(g)反应的化学方程式并标出该反应电子转移的方向和数目:___________________。
(3)向Z 溶液中通入足量的Cl2,写出检验Z 中阳离子所需试剂___________。
(4)向含 10g D 的溶液中通入一定量的 X,完全反应后,在低温条件下蒸发结晶,最终得到 14.8g 固体。
①简述蒸发结晶在低温条件下进行的理由:______________(用必要的文字回答)
②所得固体中含有的物质及其它们的物质的量之比为____________。
【答案】 Na2O2 Na2CO3 NaOH 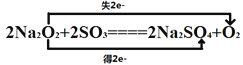 硫氰化钾溶液或KSCN 避免碳酸氢钠在温度过高时分解 n(Na2CO3):n(NaHCO3)=2:1
硫氰化钾溶液或KSCN 避免碳酸氢钠在温度过高时分解 n(Na2CO3):n(NaHCO3)=2:1
【解析】A为淡黄色固体化合物,X为无色气体,D为一种常见的强碱,并且X与D反应生成B溶液,所以X为酸性气体,B为盐,所以不难推出A是Na2O2,X为CO2,B为Na2CO3,C是O2,B与氢氧化钡生成D,则D为NaOH,Z为浅绿色溶液,说明含有亚铁离子,亚铁离子与NaOH溶液反应生成E为Fe(OH)2,Fe(OH)2与O2、水反应生F为Fe(OH)3。(1)通过以上分析知,A、B、D分别是Na2O2、Na2CO3、NaOH,(2)根据过氧化钠和二氧化碳的反应生成Na2CO3和O2,可以推知三氧化硫和过氧化钠反应生成硫酸钠和氧气,即2Na2O2+2SO3=2Na2SO4+O2,该反应中只有Na2O2中O元素的化合价发生变化,分别由﹣1价变化为0价和﹣2价,即转移电子数为2,用双线桥法表示电子转移方向和数目为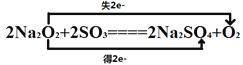 ;(3)Z为浅绿色溶液,说明含有亚铁离子,向Z溶液中通入足量的Cl2,离子方程式为2Fe2++Cl2=2Fe3++2Cl﹣,故用硫氰化钾(KSCN)来检验Fe3+;(4)D为NaOH,X为CO2,向含NaOH溶液中通入一定量的CO2后,完全反应后,在低温条件下蒸发结晶,最终得到14.8g固体;①因为碳酸氢钠在温度过高时分解,所以蒸发结晶在低温条件下进行;②氢氧化钠的物质的量为:
;(3)Z为浅绿色溶液,说明含有亚铁离子,向Z溶液中通入足量的Cl2,离子方程式为2Fe2++Cl2=2Fe3++2Cl﹣,故用硫氰化钾(KSCN)来检验Fe3+;(4)D为NaOH,X为CO2,向含NaOH溶液中通入一定量的CO2后,完全反应后,在低温条件下蒸发结晶,最终得到14.8g固体;①因为碳酸氢钠在温度过高时分解,所以蒸发结晶在低温条件下进行;②氢氧化钠的物质的量为: ![]() =0.25mol,假设生成Na2CO3的物质的量为xmol,生成NaHCO3的物质的量为ymol,则根据钠原子守恒,2x+y=0.25,根据固体质量106x+84y=14.8,解得x=0.1,y=0.05,所以所得固体中含有的物质为Na2CO3和NaHCO3,它们的物质的量之比为n(Na2CO3):n(NaHCO3)=2:1,故答案为:Na2CO3和NaHCO3;n(Na2CO3):n(NaHCO3)=2:1。
=0.25mol,假设生成Na2CO3的物质的量为xmol,生成NaHCO3的物质的量为ymol,则根据钠原子守恒,2x+y=0.25,根据固体质量106x+84y=14.8,解得x=0.1,y=0.05,所以所得固体中含有的物质为Na2CO3和NaHCO3,它们的物质的量之比为n(Na2CO3):n(NaHCO3)=2:1,故答案为:Na2CO3和NaHCO3;n(Na2CO3):n(NaHCO3)=2:1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在酸性溶液中能大量共存而且为无色透明的溶液是
A. NH4+,Al3+,SO42-,NO3-
B. K+,Na+,NO3-,CO32-,
C. K+,MnO4-,NH4+,NO3-
D. Na+,K+,HCO3-,NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗甲流感药物达菲(Tamiflu)是以莽草酸(A)为原料,经过十步反应合成制得.莽草酸可以从常用的烹调香料“八角”中提取.达菲及A(莽草酸)、B的结构简式如图甲: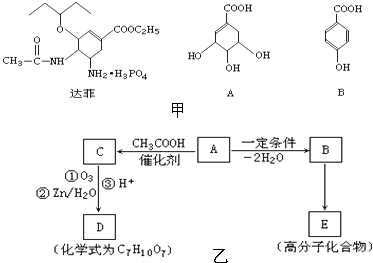
已知: ![]()
化合物A、B、C、D存在如图乙所示的转化关系:
回答下列问题:
(1)写出达菲中含氧官能团的名称:;
(2)写出A→C的反应类型:;
(3)写出B→E的化学方程式:;
(4)写出D的结构简式:;
(5)已知B有多种同分异构体,写出一种符合下列性质的B的同分异构体的结构简式①与FeCl3溶液作用显紫色;
②与新制Cu(OH)2悬浊液作用产生红色沉淀;
③苯环上的一卤代物有2种.
(6)设计A生成C的目的 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是化合物,B是金属单质,它们之间相互反应以及生成物之间的转化关系如图所示: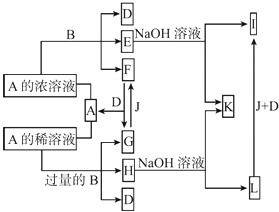
(1)金属B在元素周期表中的位置是 , B和A的浓溶液反应的条件是 . 写出少量B与A的稀溶液反应的离子方程式: .
(2)常温下0.1 mol/L E的水溶液中各离子浓度大小关系为 .
(3)L转化为I的现象是 . 写出有关的化学方程式: .
(4)如何检测H溶液中阳离子的存在,写出实验操作方法、现象、结论: .
(5)已知25℃时Fe(OH)3的Ksp=3.5×10﹣39 , 现将4.0×10﹣8 mol/L E溶液与2.0×10﹣8 mol/L NaOH溶液等体积混合(忽略溶液混合时体积的变化),通过列式计算说明是否有沉淀产生: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中和热的测定实验(如图). 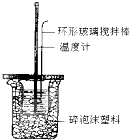
①量取反应物时,取50mL0.50molL﹣1的盐酸,还应加入的试剂是(填序号).
A.50mL0.50molL﹣1NaOH溶液
B.50mL0.55molL﹣1NaOH溶液
C.1.0gNaOH固体
②在该实验过程中,该同学需要测定的实验数据有(填序号).
A.盐酸的浓度 B.盐酸的温度
C.氢氧化钠溶液的浓度 D.氢氧化钠溶液的温度
E.水的比热容 F.反应后混合溶液的终止温度
③若用50mL0.5molL﹣1醋酸溶液代替上述盐酸测定中和热,所得数据 . (填“偏大”或“偏小”或“不变”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应与四种基本反应类型的关系如图所示,则下列化学反应属于阴影 3 区域的是

A. Cl2+2NaI==2NaCl+I2 B. CH4+2O2![]() CO2+2H2O
CO2+2H2O
C. 4Fe(OH)2+O2+2H2O=4Fe(OH)3 D. 2H2O2![]() 2H2O+O2↑
2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同条件下,2mLX(气)跟5mLC2(气)恰好完全反应,生成4mLAC2(气)与2mLB2C(气),则X的分子式是( )
A. ABB. B2CC. A2B2D. BC2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大.已知Y原子最外层电子数与核外电子总数之比为3:4;M原子最外层电子数与次外层电子数之比为3:4;N﹣、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体.据此回答:
(1)M、N的最高价氧化物的水化物中酸性较强的是(写出化学式) .
(2)Z与M可形成常见固体化合物C,用电子式表示C的形成过程 .
(3)已知通常状况下1 g X2在Y2中完全燃烧放出a kJ的热量,请写出表示X2燃烧热的热化学方程式 .
(4)X与Y、X与M均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,写出该反应的化学方程式 .
(5)化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1:1:1,A溶液中水的电离程度比在纯水中小.则化合物A中的化学键类型为;若B为常见家用消毒剂的主要成分,则B的化学式是 .
(6)均由X、Y、Z、M四种元素组成的两种盐发生反应的离子方程式是;其中一种是强酸所成的酸式盐,写出Ba(OH)2溶液中逐滴加入该盐溶液至中性的离子方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题;(回答问题时,均需使用元素的真实元素符号,不得使用数字编号)
族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | Ⅷ |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ |
(1)②、⑤、⑥的离子半径由大到小的顺序为
(2)写出由①、②两元称组成,且①的质量分数最高的分子的电子式 ,
写出该化合物跟⑧的单质发生置换反应的化学方程式 .
(3)元素⑥的最高价氧化物可和元素⑤的氢氧化物水溶液发生反应,写出反应的离子方程式
(4)元素③有多种氧化物,其中甲的相对分子质量最小;元素④有多种单质,其中乙的相对分子质量最小.在一定条件下,将2L 甲气体与1.5L 乙气体均匀混合,若该混合气体被足量NaOH 溶液完全吸收(没有气体残留).所生成的含氧酸盐的化学式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com