
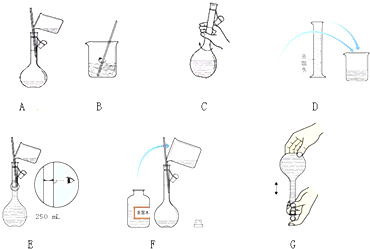
分析 (1)依据m=CVM计算溶质的质量;
(2)根据容量瓶的使用注意事项解答;
(3)根据配制一定物质的量浓度溶液的实验操作的步骤解答;
(4)依据容量瓶规格选择方法及定容的正确操作,配制100mL 1mol•L-1NaOH溶液,应选择100mL容量瓶,定容时,先直接向容量瓶中加入蒸馏水到离刻度线1-2cm处,改用胶头滴管逐滴滴加到凹液面最低处与刻度线相切,所以错误的为E;
(5)依据溶液稀释前后所含溶质的物质的量不变计算稀释后氢氧化钠的物质的量浓度,1mol氢氧化钠含有1mol钠离子,所以钠离子浓度等于氢氧化钠浓度;
(6)操作失误,无法弥补的,必须重新配制;
(7)分析不当操作对溶质的物质的量和溶液的体积的影响,依据C=n/V进行误差分析.
解答 解:(1)配制100mL 1mol•L-1NaOH溶液,需要氢氧化钠的质量=0.1L×1mol/L×40g/mol=4.0g,
故答案为:4.0;
(2)使用容量瓶前必须进行的一步操作是查漏,
故答案为:查漏;
(3)配制一定物质的量浓度溶液的步骤是:计算、量取、稀释、冷却、移液、定容、摇匀、装瓶、贴签,正确的操作顺序为:DBACFEG,
故答案为:ACFE;
(4)配制100mL 1mol•L-1NaOH溶液,应选择100mL容量瓶,定容时,先直接向容量瓶中加入蒸馏水到离刻度线1-2cm处,改用胶头滴管逐滴滴加到凹液面最低处与刻度线相切,所以错误的为E;应改为用胶头滴管定容,容量瓶规格应选择100mL;
故答案为:E;应改为用胶头滴管定容,容量瓶规格应选择100mL;
(5)设稀释后碳酸钠浓度为C,则依据溶液稀释前后所含溶质的物质的量不变计算,C×100ml=1mol/L×10mL,解得C=0.1mol/L,1mol氢氧化钠含有1mol钠离子,所以钠离子浓度等于氢氧化钠浓度倍,所以钠离子的物质的量浓度为0.1mol/L;
故答案为:0.1mol/L;
(6)若进行E步操作时加蒸馏水超过刻度线,操作失误且无法弥补,必须重新配制;
故答案为:重新配制;
(7)A.移液前,容量瓶中有少量蒸馏水对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故A不选;
B.溶解搅拌时有液体飞溅,导致溶质的物质的量偏低,溶液的物质的量浓度偏低,故B不选;
C.定容时俯视容量瓶瓶颈刻度线,导致溶液体积偏小,溶液浓度偏高,故C选;
D.没有用蒸馏水洗涤烧杯和玻璃棒,导致溶质的物质的量偏小,溶液浓度偏低,故D不选;
E.定容后,倒置容量瓶摇匀,平放静置,液面低于刻度线,再加水定容,导致溶液体积偏大,溶液用到偏低,故E不选;
故选:C.
点评 本题考查了一定物质的量浓度溶液的配制以及误差分析,明确配制的一般步骤和原理是解题关键,注意误差分析的方法和技巧.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种溶液中,水的电离程度:①>② | |
| B. | 分别中和等体积相同物质的量浓度的NaOH溶液,则消耗溶液的体积:①<② | |
| C. | 等体积的①、②溶液分别与足量铝粉反应,生成H2的质量:①=② | |
| D. | 将等体积的①、②溶液中分别稀释10倍后,溶液的pH:①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
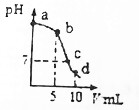 25℃时,向10mL 0.2mol•L-1 NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.已知:Ka(HCN)=6.4×10-10.下列叙述错误的是( )
25℃时,向10mL 0.2mol•L-1 NaCN溶液中加入0.2mol•L-1盐酸,溶液pH随加入盐酸的体积变化情况如图所示.已知:Ka(HCN)=6.4×10-10.下列叙述错误的是( )| A. | a点时,CN-离子浓度大于其他点 | B. | b点时,c(HCN)>c(CN-) | ||
| C. | c点时,c(Na+)=c(Cl-)+c(CN-) | D. | d点时,溶液的c(H+)≈8×10-5mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com