
【题目】下列有关二氧化硅的叙述中不正确的是
A.沙子、石英、水晶的主要成分都是SiO2
B.SiO2是制光导纤维的主要原料
C.硅酸可由SiO2直接制得
D.SiO2是酸性氧化物,一定条件下可与碱性氧化物或碱反应
科目:高中化学 来源: 题型:
【题目】常温下,现向50 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.05 mol·L-1 NaOH溶液,得到溶液的pH与NaOH溶液体积的关系曲线如图所示(假设滴加过程中无气体产生)。下列说法正确的是

A.b点溶液中离子浓度由大到小的顺序为:c(Na+)>c(SO![]() )>c(NH
)>c(NH![]() )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B.图中b、c、d三点溶液中水的电离程度最大的是c点
C.b点后滴加NaOH溶液过程中,NH3·H2O的电离程度逐渐减小
D.pH=7时,溶液中c(H+)+c(Na+)+c(NH![]() )=c(SO
)=c(SO![]() )+c(OH-)
)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是
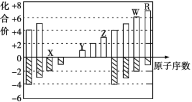
A. 气态氢化物的稳定性:R>W
B. X与Y可以形成原子个数比为1:1和1:2的两种离子化合物
C. 由X、Y、Z、W、R五种元素形成的简单离子中半径最小的是X2-
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜有氧化铜和氧化亚铜两种氧化物,关于它们的比较说法中不正确的是( )
A.氧化铜为黑色,氧化亚铜为红色B.铜元素的化合价不相同
C.都能溶于水生成氢氧化铜蓝色沉淀D.都能被氢气还原为单质铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是( )
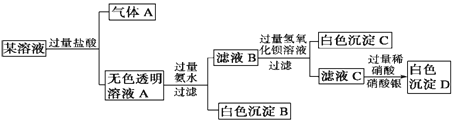
A. 原溶液中一定只存在AlO2-、CO32-、SO42-、Cl- 四种离子
B. 气体A的化学式是CO2,其电子式为O::C::O
C. 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+
D. 生成沉淀B的离子方程式为:Al3++ 3OH- = Al(OH)3 ↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.氯化钠溶液能导电,所以氯化钠溶液是电解质
B.氯化氢溶液能导电,所以氯化氢是电解质
C.固态氯化钾不导电,所以氯化钾是非电解质
D.液态硫酸不导电,所以硫酸是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物含有4个C,每个C原子都以键长相等的三条单键连接3个C,且整个结构中所有碳碳键之间的夹角都为60°,则下列说法不正确的是
A. 该有机物中C采取sp2杂化
B. 该有机物的一氯代物仅有1种
C. 该有机物的碳原子构成正四面体
D. 该有机物的不饱和度为3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S 和SO2 会对环境和人体健康带来极大的危害,工业上采取多种方法来减少这些有害气体的排放。
I.H2S 的除去
方法1: 生物脱H2S,反应的原理为H2S + Fe2(SO4)3==S↓+2FeSO4+H2SO4、4FeSO4+O2+2H2SO4![]() 2Fe2(SO4)3 +2H2O。
2Fe2(SO4)3 +2H2O。
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105 倍,该菌的作用是______。
(2)由图1和图2 判断,使用硫杆菌的最佳条件为_________。若反应温度过高,反应速率下降,其原因是______________。


方法2: 在一定条件下,用H2O2 氧化H2S
(3)随着参加反应的n(H2O2)/n(H2S) 变化,氧化产物不同。当n(H2O2)/n(H2S)=4时,氧化产物 的分子式为________。
II.SO2 的除去
方法1( 双碱法): 用NaOH 吸收SO2 ,并用CaO 使NaOH 再生:NaOH 溶液![]() Na2SO3
Na2SO3
(4)写出过程①的离子方程式:_________________。
(5)CaO 在水中存在如下转化:CaO(s)+H2O(1)= Ca(OH)2(s)![]() Ca2+(aq) +2OH- (aq)。从平衡移动的角度,简述过程②NaOH再生的原理:_______________。
Ca2+(aq) +2OH- (aq)。从平衡移动的角度,简述过程②NaOH再生的原理:_______________。
方法2:用氨水除去SO2
(6)已知25℃,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。若氨水的浓度为2.0mol/L,溶液中的c(OH-)=________。将SO2 通入该氨水中,当c(OH-)降至1.0×10-7mol/L时,溶液中的c (SO32-)/c(HSO3-) =_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】南海是一个巨大的资源宝库,开发利用这些资源是科学研究的重要课题。下图为海水资源利用的部分过程,有关说法正确的是( )
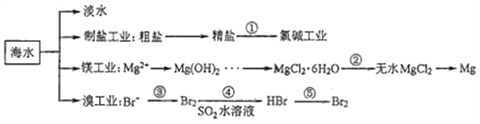
A. 海水淡化的方法主要有蒸馏法、电渗析法、冰冻法
B. 氯碱工业中采用阴离子交换膜可提高产品的纯度
C. 由MgCl2·6H2O得到无水MgCl2的关键是要低温小火烘干
D. 溴工业中③、④的目的是为了富集溴元素,溴元素在反应③、⑤中均被氧化,在反应④中被还原
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com