
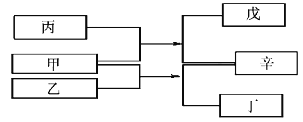
【题目】A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,辛是由C元素形成的单质,常温常压下乙为液体。常温下,0.1mol/L 丁溶液的pH为13,上述各物质间的转化关系如图所示。下列说法正确的是
A. 元素B、C、D的原子半径由大到小的顺序为 r(D)>r(C)>r(B)
B. 1L0.lmol/L戊溶液中阴离子的总物质的量小于0.1mol
C. 1mol甲与足量的乙完全反应共转移了约6.02×1023个电子
D. 元素的非金属性B > C > A
【答案】C
【解析】常温下,0.1mol/L 丁溶液的pH为13,丁是一元强碱,为NaOH,发生甲+乙=丁+辛,甲、乙中含H、O、Na,辛是由C元素形成的单质为O2,故甲为Na2O2,乙是水,再由甲+丙=戊+辛,可知丙为CO2,戊是Na2CO3,四种元素分别是H、C、O、Na。
A、同周期,从左到右,原子半径随着原子序数的递增,半径逐渐减小,同主族,从上到下,原子半径随着原子序数的递增,半径逐渐增大,原子半径大小顺序为Na、C、O,故A错误;B、Na2CO3中CO32―要部分水解,CO32-+H2O![]() HCO3-+OH-,HCO3-+H2O
HCO3-+OH-,HCO3-+H2O![]() H2CO3+OH-,由电荷守恒可知,1molCO32―可水解生成2molOH― , 1L0.lmol/L戊溶液中阴离子的总物质的量大于0.1mol,故B错误;C、由2Na2O2+2H2O=4NaOH+O2,每1molNa2O2反应转移1mol电子,故C正确;D、元素的金属性与非金属性(1)同一周期的元素从左到右金属性递减,非金属性递增;(2)同一主族元素从上到下金属性递增,非金属性递减,元素的非金属性应是O > C ,故D错误。故选C。
H2CO3+OH-,由电荷守恒可知,1molCO32―可水解生成2molOH― , 1L0.lmol/L戊溶液中阴离子的总物质的量大于0.1mol,故B错误;C、由2Na2O2+2H2O=4NaOH+O2,每1molNa2O2反应转移1mol电子,故C正确;D、元素的金属性与非金属性(1)同一周期的元素从左到右金属性递减,非金属性递增;(2)同一主族元素从上到下金属性递增,非金属性递减,元素的非金属性应是O > C ,故D错误。故选C。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】在工业上,通过含锌矿石制取应用广泛的锌及其化合物。
(1)Zn在元素周期表中位于_____区,其基态原子价电子排布式为________。
(2)[Zn(CN)4]2-常用于电镀工业中,其中配位原子基态时核外电子的轨道表示式为_____,与CN-互为等电子体的粒子有_____、________(写出两种)。
(3)[Zn(CN)4]2-在水溶液中与甲醛(HCHO)溶液反应可制得HOCH2CN。甲醛分子的立体构型为________.中心原子杂化方式为________;HOCH2CN中元素电负性由大到小的顺序_______,1 mol HOCH2CN分子中,含有σ键的数为_________。
(4)ZnS和HgS晶体在岩浆中先晶出的是________,其原因是___________。
(5)ZnO的一种晶体结构与金刚石类似,4 个锌原子占据金刚石中晶胞内四个碳原子的位置,则该氧化物的密度为______g/cm3(设晶胞参数为apm,NA表示阿伏伽德罗常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化合物的核磁共振氢谱中出现三组峰的是
A. 2,2,3,3一四甲基丁烷 B. 2,3,4一三甲基戊烷
C. 3,4一二甲基己烷 D. 2,5一二甲基己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—种熔融碳酸盐燃料电池原理示意如图。下列有关该电池的说法正确的是

A. 电池工作时,CO32-向B电极栘动
B. 电极B上发生的电极反应为O2+2CO2+4e- =2CO32-
C. 电极A上H2参与的电极反应为H2+2OH- +2e-=2H2O
D. 反应CH4+H2O![]() 3H2+CO,每消耗 1molCH4转移 12mol电子
3H2+CO,每消耗 1molCH4转移 12mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:氮化铝(AlN)溶于强酸产生铝盐,溶于强碱生成氨气。
(1)AlN与NaOH溶液反应的化学方程为_______。
(2)甲同学通过测定AlN与NaOH溶液反应产生氨气的质量来测定AlN的纯度(假设杂质不参与反应,忽略NH3在强碱性溶液中的溶解)。实验装置如下:

①选择上图中合适的装置,其连接顺序为______(按气流从左到右方向,填字母)。
②装置A中干燥管的作用是________。
(3)乙同学通过测定氨气体积来测定AlN的纯度。

①导管a的作用是________。
②读数前,需要进行的操作是_______。
③若称取样品的质量为mg,量气管中测定的气体体积为VmL,该实验条件下的气体摩尔体积为VmL/mol,则AlN的质量分数为______;若读取量气管中气体的体积时,液面左高右低,则测得的AlN的纯度______(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com