
| 步骤 | 操作 | 现象 |
| Ⅰ | 向2mL 1mol?L-1 FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色, 并有少量刺激性气味的气体逸出 |
| 步骤 | 操作 | 现象 |
| Ⅱ | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
| 步骤 | 操作 | 现象 |
| Ⅲ | 向1mol?L-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| Ⅳ | 用激光笔照射步骤III中的红褐色溶液 | 没有出现“丁达尔效应” |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、胶体中分散质的直径介于1nm~100nm之间,用渗析的方法净化胶体时,使用的半透膜只能让较小的分子、离子通过 |
| B、光线透过胶体时,能发生丁达尔效应,利用丁达尔效应可以区别溶液与胶体 |
| C、布朗运动是胶体的性质之一,布朗运动是胶体稳定的次要原因 |
| D、胶体粒子具有较大的表面积,有的能吸附阳离子或阴离子,故在电场作用下会产生电泳现象,电泳现象可证明胶体属于电解质溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入适量烧碱固体 |
| B、加入适量稀盐酸 |
| C、加入适量稀硫酸 |
| D、加水稀释 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 取等物质的量的两种金属单质X、Y, 分别与足量的盐酸反应 |
X产生氢气的体积比Y多 | 金属性:X>Y |
| B | 向滴有甲基橙的AgNO3溶液中滴加KCl溶液 | 溶液由红色变为黄色 | KCl溶液具有碱性 |
| C | 在CuSO4溶液中加入KI溶液,再加入苯,振荡 | 有白色沉淀生成,苯层呈紫色 | 白色沉淀可能为CuI |
| D | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | Z | W | |
| 结构 或 性质 |
X的最高价氧化物对应的水化物与其气态氢化物反应可得到一种盐 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,Z的离子半径最小 | 原子核外最外层电子数是次外层电子数的一半 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D为原子序数依次增大的前四周期元素,元素A原子最外层电子数比内层多3个,元素B基态原子核外有2个未成对电子,元素C的最高价和最低价代数和等于0,元素D位于周期表ⅥB族.
A、B、C、D为原子序数依次增大的前四周期元素,元素A原子最外层电子数比内层多3个,元素B基态原子核外有2个未成对电子,元素C的最高价和最低价代数和等于0,元素D位于周期表ⅥB族.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
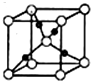 向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得铜锰氧化物CuMn2O4.在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O.
向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得铜锰氧化物CuMn2O4.在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com