
在一定温度下,向容积固定的密闭容器里充入a mol N2O4发生如下反应:N2O4 (气) 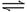 2NO2 (气),达到平衡后,再向该容器内充入a mol N2O4,达平衡后与原平衡比较正确的是 ( )
2NO2 (气),达到平衡后,再向该容器内充入a mol N2O4,达平衡后与原平衡比较正确的是 ( )
A.平均相对分子质量减小 B.N2O4的转化率提高
C.压强为原来的2倍 D.颜色变深
 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素在元素周期表中的位置为 ;
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2O4 (1) △H1= -19.5kJ·mol-1
②N2H4 (1) + O2(g)= N2(g) + 2 H2O(g) △H2= -534.2kJ·mol-1
写出肼和N2O4 反应的热化学方程式 ;
(4)肼一空气燃料电池是一种碱性电池,该电池放电时,负极的反应式为
(5)下图是一个电化学过程示意图。

①写出铂片上发生的电极反应式____ ____。
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化128 g,则肼-空气燃料电池理论上消耗标准状况下的空气_____ ___L(假设空气中氧气体积含量为20%)。
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需用240 mL 0.1 mol·L-1的硫酸铜溶液,现选取250 mL容量瓶进行配制,以下操作能配制成功的是( )
A.称取3.84 g CuSO4粉末,加入250 mL水
B.称取6.25 g CuSO4·5H2O晶体,加水配成250 mL溶液
C.称取4.0 g CuSO4粉末,加入250 mL水
D.称取4.0 g CuSO4·5H2O晶体,加水配成250 mL溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室中需要11.2L(标准状况)二氧化碳,现用含碳酸钙90.0﹪的石灰石与足量的稀盐酸反应(该石灰石中的杂质不与稀盐酸反应),问:
(1)至少需要含碳酸钙90.0﹪的石灰石多少克?
(2)生成的氯化钙的物质的量是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中,反应3A(g)+B(s)  2C(g)+2D(g) ΔH >0达到平衡后,改变以下条件,下列说法正确的是( )
2C(g)+2D(g) ΔH >0达到平衡后,改变以下条件,下列说法正确的是( )
A.增大压强,正、逆反应速率同等程度增大,平衡不移动
B.升高温度,正反应速率增大,逆反应速率减小,平衡向正方向移动
C.增加A的浓度,平衡向正方向移动,平衡常数增大
D.增加B的用量,正、逆反应速率不变,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
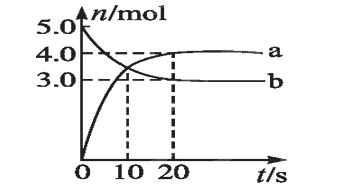
N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在2 L固定容积的密闭容器中发生:2N2O5(g) 4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中,正确的是( )
4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中,正确的是( )
[  ]
]
A.0~20 s内平均反应速率v(N2O5)=0.1 mol·(L·s)-1
B.10 s时,正、逆反应速率相等,达到平衡
C.20 s时,正反应速率大于逆反应速率
D.曲线a表示NO2的物质的量随反应时间的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)一定条件下的密闭容器中,反应3H2(g)+3CO(g) CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。 [
CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。 [
a.升高温度 b.加入催化剂 c.减小CO2的浓度
d.增加CO的浓度 e.分离出二甲醚
(2)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol·L-1) | 0.44 | 0.6 | 0.6 |
①比较此时正、逆反应速率的大小:v(正) v(逆)(填“>”“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)= ;该时间内反应速率v(CH3OH)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
恒温、恒压下,在一个容积可变的容器中发生如下反应:
N2(g) + 3H2(g)  2NH3(g)
2NH3(g)
(1)若开始时放入1mol N2和3 molH2,达到平衡后,生成a mol NH3,这时N2的物质的量为 mol;
(2)若开始时无NH3,只放入N2和H2,达到平衡时生成NH3的物质的量为3a mol,则开始时放入N2和H2的物质的量分别为 mol和 mol;
(3)若开始时放入x mol N2、6 molH2和2 molNH3,达到平衡后,N2和NH3的物质的量分别为y mol和3a mol,则x= ,y= ,平衡时H2的物质的量_____(选填一个编号)。
A.大于6 mol B.等于6 mol C.小于6 mol D.可能大于、小于或等于6 mol
作出判断的理由是 ;
(4)若在(3)的平衡混合物中,再加入6 molNH3,再次达到平衡后,NH3的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
钾是一种活泼的金属,工业上通常用金属钠和氯化钾在高温下反应
制取。该反应为:Na(l)+ KCl(l)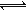 NaCl(l)+ K(g) ΔH>0 该反应的平衡
NaCl(l)+ K(g) ΔH>0 该反应的平衡
常数可表示为:K = C(K) 各物质的沸点与压强的关系见下表。
| 压强(kPa) | 13.33 | 53.32 | 101.3 |
| K的沸点(℃ ) | 590 | 710 | 770 |
| Na的沸点(℃ ) | 700 | 830 | 890 |
| KCl的沸点(℃ ) | 1437 | ||
| NaCl的沸点(℃ ) | 1465 |
(1)在常压下金属钾转变为气态从反应混合物中分离的最低温度约为 ,
而反应的最高温度应低于 ;
(2)在制取钾的过程中,为了提高原料的转化率可以采取的措施是
(任写一条);
(3)常压下,当反应温度升高至 900℃ 时,该反应的平衡常数可表示为:
K = 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com