
现有等物质的量的铜和银的混合物17.2克,与50.0mL的浓硝酸恰好完全反应,产生气体4.48L(标准状况),则下列说法正确的是
A.产生的气体是0.2molNO2
B.硝酸的物质的量浓度为12mol/L
C.反应中被还原和未被还原的硝酸物质的量之比为3:2
D.要使产生的气体恰好完全被水吸收需要通入氧气0.075mol
D
【解析】根据题意Cu、Ag的物质的量均为0.1 mol,则反应中共失去电子0.3 mol ,HNO3得电子0.3 mol,若生成0.2molNO2,则HNO3得电子0.2 mol,A错误,未被还原的HNO3为0.1 mol×2+0.1 mol×1=0.3 mol,参加反应的HNO3共0.3 mol+4.48L/22.4Lmol-1 =0.5 mol ,则硝酸的物质的量浓度为10mol/L ,B、C错误,根据D项题意HNO3只起到酸的作用,整个反应可看作Cu、Ag与O2反应,生成的氧化物溶于HNO3,即2Cu~O2 4Ag~O2,D正确。
,B、C错误,根据D项题意HNO3只起到酸的作用,整个反应可看作Cu、Ag与O2反应,生成的氧化物溶于HNO3,即2Cu~O2 4Ag~O2,D正确。
易错点拨:不能很好的利用计算的技巧而显得茫然、费时。本题可运用得失电子数相等、原子守恒、整体分析法等来解题。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014高考名师推荐化学--预测8 题型:选择题
已知某物质X能发生如下转化:
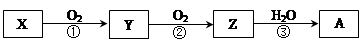
下列有关上述转化关系中物质及其反应的叙述错误的是
A若X??N2或NH3(催化氧化),则A为硝酸
B若X为S 或H2S(完全燃烧),则A为硫酸
C若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y
D反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测6 题型:选择题
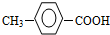 有多种同分异构体,其中符合属于酯类并含含苯环的同分异构体有多少种(不考虑立异构)
有多种同分异构体,其中符合属于酯类并含含苯环的同分异构体有多少种(不考虑立异构)
A.6 B.5 C.4 D.3
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测5 题型:简答题
C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用.请回答下列问题:
(1)32号元素Ge的原子核外电子排布式为 ;
(2)C、Si、Sn三种元素的单质中,能够形成金属晶体的是 ;
(3)已知SnO2是离子晶体,写出其主要物理性质 ;(写出2条即可)
(4)已知:
| CH4 | SiH4 | NH3 | PH3 |
沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
分解温度(K) | 873 | 773 | 1073 | 713.2 |
分析上表中四种物质的相关数据,请回答:
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是 ;
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是 ;
结合上述数据和规律判断,一定压强下HF和HCl的混合气体降温时 ;
(5))用价层电子对互斥理论推断SnBr2分子中Sn—Br的键角 120°(填“>”“<”或“=”)。
(6)铅、钡、氧形成的某化合物的晶胞结构是:Pb4+处于立方晶胞顶点,Ba2+处于晶胞中心,O2-处于晶胞棱边中心,该化合物化学式为 ,每个Ba2+与 个O2-配位。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测5 题型:选择题
8.34gFeS04·7H20样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示
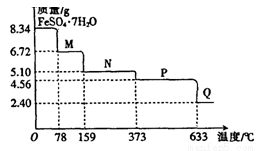
A.温度为78℃时固体物质M的化学式为FeSO4?5H2O
B.温度为l59℃时固体物质N的化学式为FeSO4?3H2O
C.在隔绝空气条件下,N得到P的化学方程式为FeSO4 FeO+SO3↑
FeO+SO3↑
D.取适量380℃时所得的样品P,隔绝空气加热至650℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe2O3
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:简答题
实验室采用MgCl2、AlCl3的混合溶液与过量氨水反应制备MgAl2O4,主要流程如下
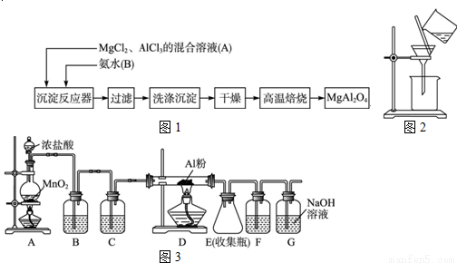
(1)为使Mg2+、Al3+同时生成沉淀,应先向沉淀反应器中加入 (填“A”“B”或),再滴加另一反应物。制备MgAl2O4过程中,高温焙烧时发生反应的化学方程式 。
(2)如下图所示,过滤操作中的一处错误是 。
(3)判断流程中沉淀是否洗净所用的试剂是 ,高温焙烧时,用于盛放固体的仪器名称是 。
(4)无水AlCl3(183℃升华)遇潮湿空气即产生大量白雾,实验室可用下列装置制备。装置B中盛放饱和NaCl溶液,该装置的主要作用是 ,F中试剂的作用是 。用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为 ;
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:选择题
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子半径最大的,X原子最外层电子数是核外电子 层数的3倍,Y的最高正价与最低负价代数和为6。下列说法正确的是
层数的3倍,Y的最高正价与最低负价代数和为6。下列说法正确的是
A.Y元素最高价氧化物对应的水化物化学式H2YO4
B.原子半径由大到小的顺序为:Z>Y> W
C.X、Z两种元素的气态氢化物中,Z的气态氢化物较稳定
D.X与W形成的两种化合物中,阴、阳离子物质的量之比均为1︰2
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测3 题型:填空题
VA族的氮、磷、砷(As)等元素的化合物在科研和生产中有许多重要用途,请回答下列问题。
(1)砷的基态原子的电子排布式为 。
(2)N、P、As原子的第一电离能由大到小的顺序为 。
(3)NH3的沸点比PH3 高,原因是 ;PO43-离子的立体构型为 。
高,原因是 ;PO43-离子的立体构型为 。
(4)PH3分子中P原子采用 杂化。
(5)H3AsO4和H3A sO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因 。
sO3是砷的两种含氧酸,请根据结构与性质的关系,解释H3AsO4比H3AsO3酸性强的原因 。
(6) CuCl2与氨水反应可形成配合物[Cu(NH3)4]Cl2,1mol该配合物中含有σ键的数目为 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测17 题型:选择题
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如图所示。有关说法不正确的是
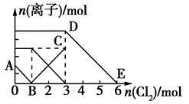
A.线段BC代表Fe3+物质的量的变化情况
B.原混合溶液中n(FeBr2)=3 mol
C.当通入2 mol Cl2时,溶液中已发生的离子反应可表示为:
2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
D.原溶液中n(Fe2+):n(I-):n(Br-)=3:1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com