
| A、①③④ | B、②③⑥ |
| C、①④ | D、①③④⑤ |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
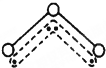 臭氧分子的结构如图,呈V型,三个原子以一个O原子为中心,与另外两个O原子分别构成共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键:三个O原子均等地享用这4个电子.则下列微粒中与O3的结构最相似的是( )
臭氧分子的结构如图,呈V型,三个原子以一个O原子为中心,与另外两个O原子分别构成共价键;中间O原子提供2个电子,旁边两个O原子各提供一个电子,构成一个特殊的化学键:三个O原子均等地享用这4个电子.则下列微粒中与O3的结构最相似的是( )| A、SO2 |
| B、C3H6 |
| C、CO2 |
| D、CNO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在任何化学反应中,只要提高反应温度,就可提高反应速率 |
| B、在任何化学反应中,只要增大某一反应物的用量,就会增大反应速率 |
| C、在任何化学反应中,增大压强时,都会使反应速率增大 |
| D、在任何化学反应中,只要缩小容器的体积,都会使反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
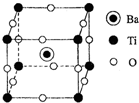
| A、配位数为6 |
| B、配体为NH3和Cl- |
| C、[Zn(NH3)4]2+为内界 |
| D、Zn2+和NH3以离子键结合 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用稀硝酸洗去残留在试管壁上的铜 |
| B、用浓硫酸吸收氨气中的水蒸气 |
| C、用稀盐酸清洗做焰色反应的铂丝 |
| D、用浓硫酸吸收氯气中的水蒸气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、①③ | C、②④ | D、③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
 钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等邻域.下面是用金红石(主要成分为TiO2)制备金属钛和钛酸钡的流程.
钛及其化合物被广泛应用于飞机、火箭、卫星、舰艇、医疗以及石油化工等邻域.下面是用金红石(主要成分为TiO2)制备金属钛和钛酸钡的流程.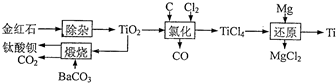
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com