
【题目】如图所示的实验装置,向盛有足量水的水槽里放两个烧杯,小烧杯里放有适量的铜片和过量的浓硝酸,小烧杯外面倒扣一个大烧杯,请回答下列问题: 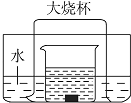
(1)实验过程中,观察到的主要现象是: ①;②;③;④ .
(2)用该装置做铜与浓硝酸反应的实验,最突出的优点是 .
(3)若要验证最终得到的气体生成物,最简便的方法是 .
【答案】
(1)铜片表面产生气泡,铜片慢慢溶解并逐渐消失;小烧杯中的溶液逐渐变成蓝色;大烧杯中有红棕色气体生成,后来慢慢变成无色;大烧杯内液面上升,水槽中液面下降
(2)反应体系密闭,无氮氧化物逸出,不污染环境
(3)轻轻掀起倒扣的大烧杯,通入适量的空气,若有红棕色气体生成,则证明最终得到的气体生成物为NO气体
【解析】解:(1)铜与浓硝酸反应生成硝酸铜和红棕色的二氧化氮气体,溶液颜色为蓝色,二氧化氮气体可与水反应生成无色的一氧化氮和硝酸,所以答案是:①铜片表面产生气泡,铜片慢慢溶解并逐渐消失;②小烧杯中的溶液逐渐变成蓝色;③大烧杯中有红棕色气体生成,后来慢慢变成无色;④大烧杯内液面上升,水槽中液面下降;(2)因Cu与浓HNO3反应生成的NO2和间接得到的NO,都是污染性气体,必须有尾气吸收装置,对比传统实验,所以该装置最突出的优点是:没有尾气处理装置,却无氮氧化合物逸出,不污染环境,所以答案是:反应体系密闭,无氮氧化物逸出,不污染环境;(3)一氧化氮与氧气反应生成二氧化氮,颜色变为红棕色,可轻轻掀起倒扣的大烧杯,放入适量的空气,若有红棕色气体生成,则证明最终气体生成物为NO气体,所以答案是:轻轻掀起倒扣的大烧杯,放入适量的空气,若有红棕色气体生成,则证明最终气体生成物为NO气体.


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】已知: Mg能在NO2中燃烧,可能产物为Mg3N2、MgO和N2。Mg3N2容易与水反应。
(1) 某实验探究小组探究Mg与NO2反应的固体产物成分,对固体产物提出三种假设:
I.假设为: 固体产物为MgO;II.假设为:________;III.假设为: ________。
(2) 该小组通过如下实验装置来验证Mg在NO2中燃烧反应产物(夹持装置省略,部分仪器可重复使用
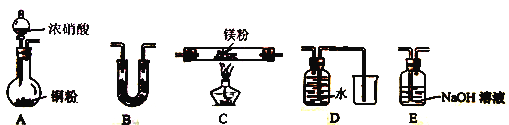
①实验装置连接的顺序为____________(填字母序号);
②装置B中盛装的试剂可以是_______ (填字母)
a.浓硫酸 b.碱石灰 c.无水CaCl2 d.五氧化二磷
③确定产物中有N2生成的实验现象为_____________________。
(3)设计实验证明: 产物中存在Mg3N2: ____________________。
(4)己知装置C中初始加入Mg粉质量为13.2g,在足量的NO2中充分燃烧,实验结束后,硬质玻璃管冷却至室温、称量,测得硬质玻璃管中剩余固体的质量为21.0g,产生N2的体积为1120mL(标准状况)。写出玻璃管中发生反应的化学方程式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学设计如下装置(图中药品均足量):
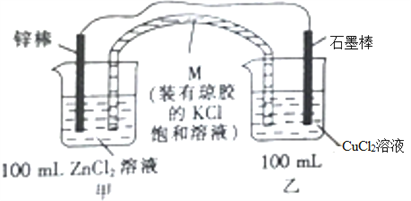
(1)M的名称是_________。
(2)烧杯乙中的现象是_____________________________。
(3)负极的电极反应式为____________________________________________,电池总反应的化学方程式为_____________。
(4)M的作用是向甲、乙两绕杯中提供K+或Cl-,以确保溶液呈电中性。当锌棒质量变化6.5g时,从M中进入装置乙内的离子是__________,其浓度为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于非金属元素Si、N、S、Cl的叙述,正确的是
A. 通常情况下,它们的单质均为气体 B. 它们在自然界中都存在游离态的单质
C. 它们都有对应的含氧酸 D. 每种元素都只有一种氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铅可用于铅蓄电池、纤维增重剂、涂料分析试剂。工业上通常用自然界分布最广的方铅矿(主要成分为PbS)生产硫酸铅。工艺流程如下:
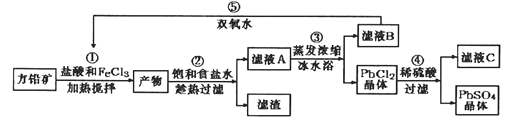
已知:①Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×l0-5。
②PbCl2(s)+2C1-(aq) ![]() PbCl42-(aq) △H>0
PbCl42-(aq) △H>0
③Fe3+、Pb2+以氢氧化物形式开始沉淀时的PH值分别为1.9和7。
(1)①中生成淡黄色沉淀的离子方程式是________________________________________________,加入盐酸控制溶液的pH在0.5-1.0之间,主要目的是____________________。
(2)用化学平衡移动的原理解释③中使用冰水浴的原因是__________________
(3)上述流程中可循环利用的物质有_______________。
(4)炼铅和用铅都会使水体因重金属铅的含量增大而造成严重污染。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、Pb(OH)3-、Pb(OH)42-。各形态的铅浓度分数x与溶液pH变化的关系如图所示:
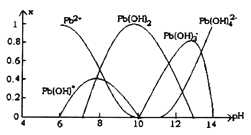
①探究Pb2+的性质:向含Pb2+的溶液中逐滴滴加NaOH,溶液变浑浊,继续滴加NaOH溶液又变澄清;pH≥13时,溶液中发生的主要反应的离子方程式为________________。
②除去溶液中的Pb2+:科研小组用一种新型试剂可去除水中的痕量铅和其他杂质离子,实验结果记录如下:
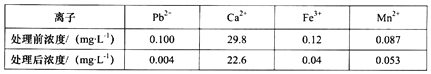
由表可知该试剂去除Pb2+的效果最好,请结合表中有关数据说明去除Pb2+比Fe3+效果好的理由是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】20℃时,将足量的BaSO4固体溶于50mL水中,充分搅拌,慢慢加入Na2CO3固体,搅拌,溶液中随c(CO32-)增大时c(Ba2+)变化曲线如下图。则下列说正确的是
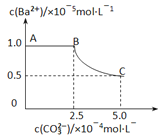
A. 20℃时Ksp(BaSO4)>Ksp(BaCO3)
B. 加入Na2CO3固体立即有BaCO3固体生成
C. BaCO3的Ksp=2.5×10-10
D. 曲线BC段内,c(CO32-):c(SO42-)=25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铁及其化合物的说法中正确的是
A. 赤铁矿的主要成分是FeO
B. 除去FeCl2溶液中的FeCl3杂质可以向溶液中加铁粉,然后过滤
C. 铁与水蒸气在高温下反应的产物为Fe2O3和H2
D. Fe3+与KSCN反应产生红色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各种石油的加工处理过程中,属于裂化过程的是( )
A.分离汽油和煤油
B.将重油分离为润滑油等
C.十六烷变为辛烷和辛烯
D.将直链烃变为芳香烃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com