
燃烧等物质的量有机物A和乙醇,消耗等量的氧气。此时乙醇反应后生成的H2O是A的1.5倍,而有机物A反应后生成的CO2是乙醇的1.5倍。则有机物A的分子式为( )
A.C3H4O B.C2H6O C.C3H4O2 D.C3H6O2
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应: Ni(s)+4CO(g) Ni(CO)4(g),
Ni(CO)4(g), H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是 (填字母编号)。
H<0。利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。对该反应的说法正确的是 (填字母编号)。
A.增加Ni的量可提高CO的转化率,Ni的转化率降低
B.缩小容器容积,平衡右移, H减小
H减小
C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低
D.当4v[Ni(CO)4]=v(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态
(2)CO与镍反应会造成镍催化剂中毒。为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫。
已知:C(s)+ O2(g)==CO(g)
O2(g)==CO(g)  H=-Q1 kJ
H=-Q1 kJ mol-1
mol-1
C(s)+ O2(g)==CO2(g)  H=-Q2 kJ
H=-Q2 kJ mol-1
mol-1
S(s)+O2(g)==SO2(g)  H=-Q3 kJ
H=-Q3 kJ mol-1
mol-1
则SO2(g)+2CO(g)==S(s)+2CO2(g)  H= 。
H= 。
(3)金属氧化物可被一氧化碳还原生成金属单质和二氧化碳。图28(3)是四种金属氧化物(Cr2O3、SnO2、PbO2、Cu2O)被一氧化碳还原时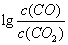 与温度(t)的关系曲线图。
与温度(t)的关系曲线图。
700oC时,其中最难被还原的金属氧化物是 (填化学式),用一氧化碳还原该金属氧化物时,若反应方程式系数为最简整数比,该反应的平衡常数(K)数值等于 。

(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如上图28(4)所示。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为 。
若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:
中国环境监测总站数据显示,颗粒物(PM2.5等)为连续雾霾过程影响空气质量最显著的污染物,其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH | SO | NO | Cl- |
| 浓度/mol•L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据计算PM2.5待测试样的pH = 。
 (2)NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
(2)NOx是汽车尾气的主要污染物之一。汽车发动机工作时会引发N2和O2反应,其能量变化示意图如下:
① N2(g)+O2(g) 2NO(g) △H= 。
2NO(g) △H= 。
② 当尾气中空气不足时,NOx在催化转化器中被还原成N2排出。写出NO被CO还原的化学方程式 。
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。发生的化学反应是:2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g)△H<0。为提高氮氧化物的转化率可采取的措施是(任意填一种)____________________。
2N2(g)+3H2O(g)△H<0。为提高氮氧化物的转化率可采取的措施是(任意填一种)____________________。
 |
(4)利用ClO2 氧化氮氧化物反应过程如下:NO NO2 N2
(反应Ⅰ试剂为:ClO2、H2O;反应Ⅱ试剂为:Na2SO3溶液)
反应Ⅰ的化学方程式是2NO+ClO2+H2O═NO2+HNO3+2HCl,反应Ⅱ的离子方程式是 ________________。若有11.2L N2生成(标准状况),共消耗NO _________________ g。
 (5)工业废气中含有的NO2还可用电解法消除。用NO2
(5)工业废气中含有的NO2还可用电解法消除。用NO2
为原料可制新型绿色硝化剂N2O5。制备方法之一是先将NO2转化为N2O4,然后采用电解法制备 N2O5,装置如图所示。Pt乙为阴极,电解池中生成N2O5的电极反应式是 。N2O4+2HNO3-2e-═2N2O5+2H+
N2O4+2HNO3-2e-═2N2O5+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | +5、+3、—3 | —2 |
下列叙述不正确的是
A.X、Y元素的金属性 : X比Y强
B.一定条件下,Z单质与W的常见单质直接生成ZW
C.Y的最高价氧化物对应的水化物能溶于的Z最高价氧化物对应的水化物的稀溶液中
D.一定条件下,W单质可以和Z氢化物反应直接生成ZW2
查看答案和解析>>
科目:高中化学 来源: 题型:
以色列科学家达尼埃尔·谢赫特曼因发现“准晶体”独获2011年诺贝尔化学奖。某准晶体W由一定比例的铁、铜、铝组成,取两小块该准晶体:一块投入烧杯①中,注入浓氢氧化钠溶液浸没固体;另一块投入烧杯②中,注入稀硫酸浸没固体。下列分析合理的是
A.烧杯①中,若构成微型电池,负极反应式为2Al-6e-=2Al3+,正极反应式为
6H++6e-=3H2↑
B.烧杯①中,若将电解质溶液换成浓硝酸,构成微型电池时铝为负极,铜为正极,
C.烧杯②中,若铁、铜构成微型电池,则铁为负极;若铝、铁构成微型电池,则铁为正极
D.烧杯②中,固体最终完全溶解,溶液呈蓝色。向溶液中滴加KSCN溶液,溶液不变色。
查看答案和解析>>
科目:高中化学 来源: 题型:
双酚A,也称BPA,用来生产防碎塑料,工业上又叫作聚碳酸酯,可以由苯酚和丙酮在酸性介质中发生缩聚反应制得,其结构如下图。每年,全世界生产2700万吨含有PBA的塑料。最近,欧盟认为含双酚A奶瓶会诱发性早熟,
从2011年3月2日起,禁止含生产化学物
质双酚A(BPA)的婴儿奶瓶。下列说法关
于双酚A的叙述不正确的是( )
A.双酚A的化学式为C15H16O2
B.常温下为白色晶体,难溶于水,易溶于丙酮
C.一溴代物有3种同分异构体,而和浓溴水反应,共能消耗2molBr2
D.每摩尔双酚A消耗氢氧化钠2摩尔,消耗碳酸钠2摩尔

查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应前后物质的总能量变化可用右图表示的是( )
A.生石灰加水生成熟石灰 B.C+H2O=CO+H2
C.金属钠与水反应 D.HNO3+NaOH=NaNO3+H2O
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
 A.在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度
A.在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即读出并记录溶液的起始温度
B.如右图,一段时间后给烧杯内地溶液中加入黄色的 溶液,可看到Fe电极附近有蓝色沉淀生成
溶液,可看到Fe电极附近有蓝色沉淀生成
C.用标准盐酸滴定待测NaOH溶液,水洗后的酸式滴定管未经标准液润洗,则测定结果偏低
D.用加热的方式可提取 固体中混有的少量的碘
固体中混有的少量的碘
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com