
物质的量浓度相同的下列溶液中,符合按pH由小到大顺序排列的是( )
| A.Na2CO3、NaHCO3、NaCl、NH4Cl |
| B.NH4Cl、NaCl 、Na2CO3、NaHCO3 |
| C.(NH4)2SO4、NH4Cl、NaNO3、Na2S |
| D.NH4Cl 、(NH4)2SO4、Na2S 、NaNO3 |
C
解析试题分析: NH4Cl强酸弱碱盐水溶液显酸性,NaCl是强酸强碱盐,溶液显中性; Na2CO3和NaHCO3都是强碱弱酸盐,水解使溶液显碱性,碱性Na2CO3>NaHCO3。所以按pH由小到大顺序排列是NH4Cl>NaCl> NaHCO3> Na2CO3。因此A、B都错误。NH4Cl是强酸弱碱盐水溶液显酸性,(NH4)2SO4是强酸弱碱盐水溶液显酸性,由于盐溶液物质的量浓度相同,铵根离子的浓度:(NH4)2SO4>NH4Cl。铵根离子的浓度越大,水解得到的c(H+)就越大,溶液的酸性就越强。所以pH大小关系是(NH4)2SO4<NH4Cl。NaNO3是强酸强碱盐,溶液显中性。Na2S是强碱弱酸盐,水解使溶液显碱性。所以pH由小到大顺序排列的是(NH4)2SO4<NH4Cl< NaNO3<Na2S。因此C正确,D错误。
考点:考查盐水解在比较盐溶液的pH的大小应用的知识。


科目:高中化学 来源: 题型:单选题
在18 ℃时,H2SO3的K1=1.5×10-2、K2=5.0×10-7,H2CO3的K1=1.4×10-7、K2=2.7×10-11,则下列说法中正确的是 ( )
| A.多元弱酸的酸性主要由第一步电离决定,亚硫酸的酸性弱于碳酸 |
| B.多元弱酸的酸性主要由第二步电离决定,碳酸的酸性弱于亚硫酸 |
| C.多元弱酸的酸性主要由第一步电离决定,亚硫酸的酸性强于碳酸 |
| D.多元弱酸的酸性主要由第二步电离决定,碳酸的酸性强于亚硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
现有常温下的四份溶液:①0.01 mol/L CH3COOH溶液;②0.0l mol/L HC1溶液;③pH=12的氨水;④pH=12的NaOH溶液。下列说法正确的是
| A.①中水的电离程度最小,③中水的电离程度最大 |
| B.将②、③混合,若pH=7,则消耗溶液的体积:②>③ |
| C.将①、④混合,若c(CH3COO-)>c(H+),则混合液一定呈碱性 |
| D.将四份溶液分别稀释100倍后,溶液的pH:③>④,①<② |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,pH=11的氨水和pH=1的盐酸等体积混合(混合溶液体积为两溶液体积之和),恰好完全中和,则下列说法错误的是( )
| A.氨水的浓度等于盐酸的浓度 |
| B.原氨水中有1%的含氮微粒为NH4+ |
| C.氨水中水电离出的c(H+)是盐酸中水电离出的c(H+)的100倍 |
| D.混合溶液中c(NH4+)+c(NH3·H2O)+c(NH3)=5×10-4mol·L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液。有关粒子的物质的量变化如图(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是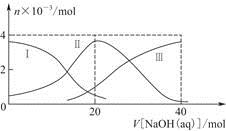
| A.当V[NaOH(aq)]=20 mL时,溶液中离子浓度大小关系: c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) |
| B.等体积等浓度的NaOH溶液与H2A溶液混合后,其溶液中水的电离程度比纯水大 |
| C.H2A第一步电离的方程式为H2A=HA-+H+ |
| D.向NaHA溶液加入水稀释的过程中,pH可能增大也可能减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,几种难溶电解质的溶度积和弱酸的电离常数如下表所示: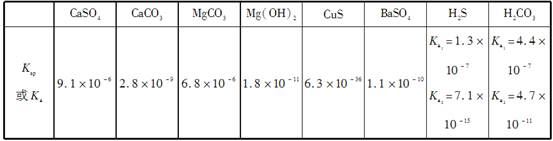
则下列说法不正确的是
| A.相同温度、相同浓度的钠盐溶液的pH:Na2S>Na2CO3>NaHS>NaCl>NaHSO4 |
| B.在NaHS溶液中滴加硫酸铜溶液,生成黑色沉淀:HS-+Cu2+=CuS↓+H+ |
| C.除去锅炉中的水垢时,通常先加入足量硫酸钠溶液,将碳酸钙转化成硫酸钙,然后再用酸液处理 |
D.在Mg(HCO3)2溶液中滴加澄清石灰水发生反应的离子方程式为Mg2++2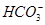 +2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O +2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
将pH=6的CH3COOH溶液加水稀释1000倍后,溶液中的( )
| A.pH=9 | B.c(OH-)≈10-5 mol·L-1 |
| C.pH≈7 | D.c(OH-)<10-7 mol·L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
有体积相同、pH相等的烧碱溶液和氨水,下列叙述中正确的是( )
| A.两溶液物质的量浓度相同 |
| B.用同浓度的盐酸中和时,消耗盐酸的体积相同 |
| C.两溶液中OH-浓度相同 |
| D.加入等体积的水稀释后,pH仍相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定温度下,一定量的石灰乳悬浊液中存在下列平衡:Ca(OH)2(s) Ca(OH)2(aq)
Ca(OH)2(aq) Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法中正确的是( )
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,下列说法中正确的是( )
| A.n(Ca2+)增大 | B.c(Ca2+)不变 | C.c(OH-)增大 | D.n(OH-)不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com