
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
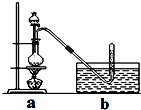
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
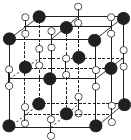 I.氮族元素和卤族元素都能形成许多种物质.
I.氮族元素和卤族元素都能形成许多种物质.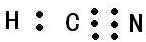 ;其中心C原子的杂化类型为sp.氮、磷、氟三种元素的电负性由大到小的顺序为F>N>P(用元素符号表示).
;其中心C原子的杂化类型为sp.氮、磷、氟三种元素的电负性由大到小的顺序为F>N>P(用元素符号表示).| F | Cl | Br | I | |
| 第一电力能(kJ•mol-1) | 1681 | 1251 | 1140 | 1008 |
| 晶体 | NaCl | KCl | CaO |
| 晶格能(kJ•mol-1) | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,C2-的电子式
,C2-的电子式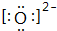 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 液态氯化氢不导电,说明它是共价化合物 | |
| B. | 若电解质溶液中分子和离子同时存在,电离方程中只能采用“?”表示 | |
| C. | 相同条件下,强电解质溶液的导电性一定比弱电解质溶液强 | |
| D. | 物质导电的本质是存在自由移动的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
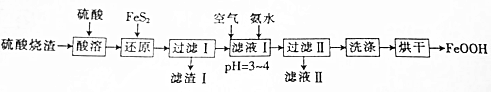
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 温度一定时,一个给定的化学反应的平衡常数是一个常数 | |
| B. | 改变反应物浓度或生成物浓度会改变平衡常数 | |
| C. | 温度一定时,对于给定的化学反应,正、逆反应的平衡常数互为倒数 | |
| D. | 浓度Qc<K时,反应向正反应方向进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com