
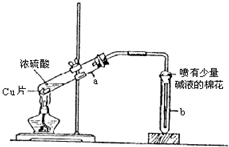
 如图为浓硫酸与铜反应的实验装置图.
如图为浓硫酸与铜反应的实验装置图.
| ||
| ||
科目:高中化学 来源: 题型:阅读理解
 实验室用浓硫酸与铜的反应制取少量 NaHSO3,实验装置如图所示.请回答:
实验室用浓硫酸与铜的反应制取少量 NaHSO3,实验装置如图所示.请回答:| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:
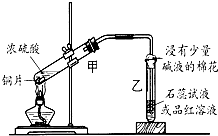 浓硫酸与铜的反应用了如图所示的装置,请回答下列问题.
浓硫酸与铜的反应用了如图所示的装置,请回答下列问题.
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
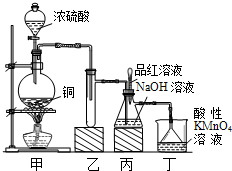 实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:| 实验操作 | 预期现象与结论 |
| 步骤1:取少量待测液放入试管中,滴加过量lmol/L氯化钡溶液.静置一段时间后,得到滤液A和固体B. | / |
| 步骤2:往固体B中加入蒸馏水洗涤沉淀,静置后弃去上层清液,向固体滴入2滴(或少量)品红,再 |
若品红褪色(或有气泡),则 |
| 步骤3: |
若 则 否则 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:
实验室用浓硫酸与铜的反应制取少量NaHSO3,实验装置如图所示:| 坩埚质量 | 坩埚与晶体总质量 | 加热后坩埚与固体总质量 |
| 11.7g | 22.7g | 18.6g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com