
【题目】“达芦那韦”是抗击新型冠状病毒潜在用药,化合物Qs是它的合成中间体,其合成路线如图:
已知:R1CHO![]() R1—CH=N—R2
R1—CH=N—R2
(1)下列说法不正确的是__。
A.有机物E所有原子一定共平面
B.核磁共振、质谱、红外光谱等可用于测定有机物I的结构
C.H→J是加成反应
D.有机物Q分子式C21H33N2O5
(2)写出化合物H的结构简式__。
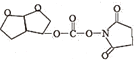
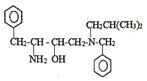
(3)写出K+L=M+P的化学方程式__。
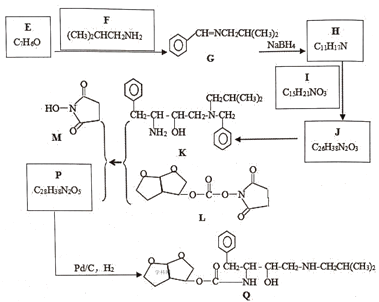
(4)设计从苯甲醇和CH3NH2为原料制备![]() 的合成路线用流程图表示,无机试剂任选)__。
的合成路线用流程图表示,无机试剂任选)__。
(5)有机物R是相对分子质量比F大14的同系物。R的1H—NMR谱表明分子中有3种氢原子,写出R符合条件的所有同分异构体的结构简式__。
【答案】AD 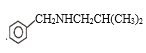
 +
+ →
→ +
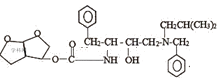
+
![]()
![]()
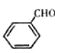
![]()
![]()
![]()
![]() (CH3)3CCH2NH2、(CH3)3CNHCH3、(CH3)2CHN(CH3)2、(CH3CH2)2NCH3
(CH3)3CCH2NH2、(CH3)3CNHCH3、(CH3)2CHN(CH3)2、(CH3CH2)2NCH3
【解析】
E与F反应生成G,结合已知信息及G的结构简式可得,E的结构简式为![]() ,G在NaBH4作用下,碳氮双键上发生加成反应(还原反应)生成H,结合H的分子式,H的结构式为
,G在NaBH4作用下,碳氮双键上发生加成反应(还原反应)生成H,结合H的分子式,H的结构式为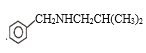 ,H与I反应生成J,结合H、I、J的分子式可得H、I中各原子数目之和与J中各原子数目相等,则 H与I反应的反应类型为加成反应;J在一定条件下反应生成K,K与L反应生成P和M,P在Pd/C、H2条件下发生取代反应生成Q,结合Q、L、M、K的结构简式,P的结构简式为
,H与I反应生成J,结合H、I、J的分子式可得H、I中各原子数目之和与J中各原子数目相等,则 H与I反应的反应类型为加成反应;J在一定条件下反应生成K,K与L反应生成P和M,P在Pd/C、H2条件下发生取代反应生成Q,结合Q、L、M、K的结构简式,P的结构简式为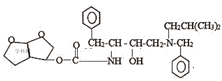 ,据此分析解答。
,据此分析解答。
(1)A.有机物E的结构简式为![]() ,由苯环和醛基构成,苯环上的所有原子在同一平面上,醛基上有碳氧双键,其三个原子在同一平面上,但苯环与醛基由碳碳单键连接,所有原子可能共平面,故A错误;
,由苯环和醛基构成,苯环上的所有原子在同一平面上,醛基上有碳氧双键,其三个原子在同一平面上,但苯环与醛基由碳碳单键连接,所有原子可能共平面,故A错误;
B.核磁共振氢谱可以在核磁共振氢谱图中,特征峰的数目反映了有机分子中氢原子化学环境的种类,不同特征峰的强度比(及特征峰的高度比)反映了不同化学环境氢原子的数目比,进而推测其在碳骨架上的位置;质谱用于精确测量生物大分子的分子量,并提供分子结构信息;用红外光照射有机物分子时,分子中的化学键或官能团可发生振动吸收,不同的化学键或官能团吸收频率不同,在红外光谱上将处于不同位置,从而可获得分子中含有何种化学键或官能团的信息,可用于测定有机物的结构,故B正确;
C.结合分析,H→J是加成反应,故C正确;
D.结合流程图示,有机物Q的环状结构中,每个节点为碳原子,并每个碳原子形成4个共价键,不足键由氢原子补齐,则分子式为C21H32N2O5,故D错误;
答案选AD;
(2)根据分析,化合物H的结构简式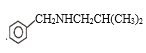
(3)K+L=M+P的化学方程式为 +
+ →
→ +
+ ;
;
(4)设计从苯甲醇和CH3NH2为原料制备![]() ,根据已知信息R1CHO
,根据已知信息R1CHO![]() R1—CH=N—R2可知,可以首先将苯甲醇氧化为苯甲醛,然后与CH3NH2反应生成
R1—CH=N—R2可知,可以首先将苯甲醇氧化为苯甲醛,然后与CH3NH2反应生成![]() ,最后与NaBH4发生还原反应即可得到目标产物,则合成路线用流程图表示为:
,最后与NaBH4发生还原反应即可得到目标产物,则合成路线用流程图表示为:![]()
![]()

![]()
![]()
![]()
![]() ;
;
(5)F的结构简式为(CH3)2CHCH2NH2,有机物R是相对分子质量比F大14的同系物,即R中比F多一个-CH2-原子团,R的1H—NMR谱表明分子中有3种氢原子,符合条件的所有同分异构体的结构简式有(CH3)3CCH2NH2、(CH3)3CNHCH3、(CH3)2CHN(CH3)2、(CH3CH2)2NCH3。


科目:高中化学 来源: 题型:
【题目】某研究性小组为探究铜丝与过量浓硫酸的反应,设计了如图所示装置进行有关实验,最后发现试管中铜有剩余。请回答:
(1)试管①中发生反应的化学方程式是 ________,该反应体现了浓硫酸的______(填“氧化性”或“还原性”)。
(2)试管②中的实验现象是______________。
(3)试管③中,NaOH的作用是____________。反应的化学方程式是______。
(4)该小组认为还应有一定的硫酸剩余,请说明铜丝未完全溶解并仍有一定量余酸的原因_______。
(5)为证明反应结束后的试管中确实有余酸,可选用下列药品中的______________ 。
A.锌粒 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(6)若想使铜继续反应可以向试管①中加入一种物质,该物质可能是_______(填序号)
A.NaNO3 B. Na2SO4 C. NaCl D.FeCl2
试写出该反应的离子方程式____________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2在一定条件下可以合成乙醇(CH3CH2OH):2CO(g)+4H2(g) ![]() CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
A. CO全部转化为乙醇
B. 正反应和逆反应的化学反应速率均为零
C. 反应体系中乙醇的物质的量浓度不再变化
D. CO和H2以1:2的物质的量之比反应生成乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质![]() 是某新型净水剂的中间体,它可以看成由AlCl3(在180℃升华)和一种盐A按物质的量之比1:2组成。在密闭容器中加热X使之完全分解,发生如下转化:
是某新型净水剂的中间体,它可以看成由AlCl3(在180℃升华)和一种盐A按物质的量之比1:2组成。在密闭容器中加热X使之完全分解,发生如下转化:
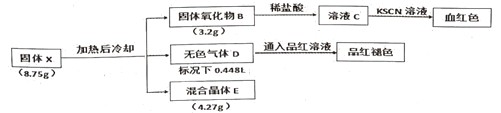
请回答下列问题:
(1)X的化学式为__。
(2)将E混合晶体溶于水配成溶液,向溶液中加入过量稀NaOH溶液时发生的总反应的离子方程式为__。
(3)高温下,若在密闭容器中长时间煅烧X,产物中还有另外一种气体,请设计实验方案验证之_。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述不正确的是( )
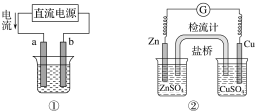
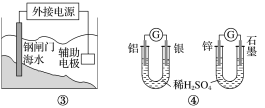
A.用图①装置实现铁上镀铜,a极为铜,电解质溶液可以是CuSO4溶液
B.图②装置盐桥中KCl的Cl-移向右烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 25℃、101kPa 时,22.4L乙烷中所含共价键数目为6NA
B. 3.2gO2和O3的混合气体中,含氧原子数为0.2NA
C. 12g金刚石含有共价键数目为4NA
D. 1molNaHSO4熔融时电离出的离子总数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物 ![]() 和
和 ![]() 的说法正确的是( )
的说法正确的是( )
A. 一氯代物数目均有6种
B. 二者均能发生取代、加成和氧化反应
C. 可用酸性高锰酸钾溶液区分
D. ![]() 分子中所有碳原子可能在同一平面上
分子中所有碳原子可能在同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“太阳水”电池装置如图所示,该电池由三个电极组成,其中a为TiO2电极,b为Pt电极,c为WO3电极,电解质溶液为pH=3的Li2SO4-H2SO4溶液。锂离子交换膜将电池分为A、B两个区,A区与大 气相通,B区为封闭体系并有N2保护。下列关于该电池的说法错误的是( )
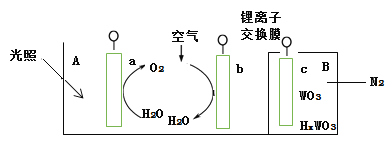
A.若用导线连接a、c,则a为负极,该电极附近pH减小
B.若用导线连接a、c,则c电极的电极反应式为HxWO3 - xe- =WO3 + xH+
C.若用导线先连接a、c,再连接b、c,可实现太阳能向电能转化
D.若用导线连接b、c, b电极的电极反应式为O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕集、利用与封存(CCUS)是我国能源领域的一个重要战略方向。CO2可转化成有机物实现碳循环。在 2 L 的恒温恒容密闭容器中,充入 2molCO2 和 6molH2,一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得 CO2 和 CH3OH(g)的浓度随时间变化如图:
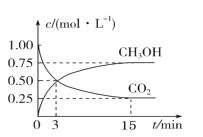
(1)从 3 min 到 15min,υ(H2)=____molL-1min-1;
(2)能说明上述反应达到平衡状态的是_____填编号)。
A. 反应中 CO2 与 CH3OH 的物质的量浓度之比为 1∶1(即图中交叉点)
B. 混合气体的压强不随时间的变化而变化
C. 单位时间内生成 1mol H2,同时生成 1mol CH3OH
D. 混合气体的平均密度不随时间的变化而变化
(3)平衡时 CO2 的转化率为 _____。
(4)平衡混合气体中 CO2(g)和 H2(g)的物质的量之比是 ______。
(5)第 3 分钟时υ正(CH3OH)______第 15 分钟时υ逆(CH3OH)(填“>”、“<” “=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com