
【题目】某研究性小组为探究铜丝与过量浓硫酸的反应,设计了如图所示装置进行有关实验,最后发现试管中铜有剩余。请回答:
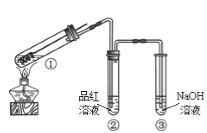
(1)试管①中发生反应的化学方程式是 ________,该反应体现了浓硫酸的______(填“氧化性”或“还原性”)。
(2)试管②中的实验现象是______________。
(3)试管③中,NaOH的作用是____________。反应的化学方程式是______。
(4)该小组认为还应有一定的硫酸剩余,请说明铜丝未完全溶解并仍有一定量余酸的原因_______。
(5)为证明反应结束后的试管中确实有余酸,可选用下列药品中的______________ 。
A.锌粒 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(6)若想使铜继续反应可以向试管①中加入一种物质,该物质可能是_______(填序号)
A.NaNO3 B. Na2SO4 C. NaCl D.FeCl2
试写出该反应的离子方程式____________________________________________ 。
【答案】Cu+2H2SO4(浓)![]() CuSO4+2SO2↑+2H2O 氧化性 品红褪色 尾气处理,防止污染环境 SO2+2NaOH=Na2SO3+H2O 随着反应的进行,浓硫酸浓度变小,氧化性变弱,不再与铜反应 A D A 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
CuSO4+2SO2↑+2H2O 氧化性 品红褪色 尾气处理,防止污染环境 SO2+2NaOH=Na2SO3+H2O 随着反应的进行,浓硫酸浓度变小,氧化性变弱,不再与铜反应 A D A 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
【解析】
(1)铜和浓硫酸在加热条件下产生硫酸铜和二氧化硫和水;
(2)二氧化硫具有漂白性,能使品红褪色;
(3)二氧化硫气体有毒,需要用NaOH做尾气处理;
(4)有部分铜剩余,是因为硫酸在稀浓度时氧化性较弱,不能完全反应掉铜;
(5)可用活泼金属、碳酸盐来检验氢离子存在;
(6)铜可在常温下与稀硝酸发生氧化还原反应。
(1)试管①中是铜和浓硫酸的反应,反应的化学方程式是:Cu+2H2SO4(浓)![]() CuSO4+2SO2↑+2H2O;反应中S元素从+6价降低至+4价,化合价降低,体现了浓硫酸的氧化性,故答案为:Cu+2H2SO4(浓)
CuSO4+2SO2↑+2H2O;反应中S元素从+6价降低至+4价,化合价降低,体现了浓硫酸的氧化性,故答案为:Cu+2H2SO4(浓)![]() CuSO4+2SO2↑+2H2O;氧化性;
CuSO4+2SO2↑+2H2O;氧化性;
(2)二氧化硫能和品红溶液反应生成无色物质而具有漂白性,能使品红溶液褪色,试管②中的实验现象是:品红褪色;
(3) SO2是有毒气体,属于酸性气体,试管③中,NaOH的作用是:尾气处理,防止污染环境;反应的化学方程式是SO2+2NaOH=Na2SO3+H2O;故答案为:尾气处理,防止污染环境;SO2+2NaOH=Na2SO3+H2O;
(4)反应中浓硫酸被消耗,同时生成水,浓硫酸逐渐变稀,而Cu不能与稀硫酸反应,故有一定量的硫酸剩余,故答案为:随着反应的进行,浓硫酸浓度变小,氧化性变弱,不再与铜反应。
(5)A.剩余的硫酸能与锌反应生成氢气,有气泡出现,A正确;
B.氯化钡与硫酸、硫酸铜反应反应得到硫酸钡沉淀,不能用它来检验硫酸是否有剩余,B错误;
C.银不与稀硫酸反应,C错误;
D.剩余的硫酸Na2CO3溶液反应生成气体,可以检验硫酸是否有剩余,D正确;
故答案选:AD;
(6)溶液有剩余的硫酸,呈酸性,可加入NaNO3,硝酸根在酸性条件下具有强氧化性,能与铜在常温下反应,反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,故答案:A;3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。


科目:高中化学 来源: 题型:
【题目】白藜芦醇广泛存在于食物(例如桑甚、花生,尤其是葡萄)中,它可能具有抗癌性。能够与1 mol该化合物发生反应的Br2和H2的最大用量分别是( )
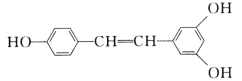
A.1mol、1molB.3.5mol、7mol
C.3.5mol、6molD.6mol、7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法不正确的是( )

A. 该晶体属于离子晶体
B. 晶体的化学式为Ba2O2
C. 该晶体晶胞结构与NaCl相似
D. 与每个Ba2+距离相等且最近的Ba2+共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过传感器可以监测空气中甲醛的含量。一种燃料电池型甲醛气体传感器的原理如图所示,下列说法错误的是

A. a为电池的正极,发生还原反应
B. b极的电极反应为HCHO+H2O-4e-==CO2+4H+
C. 传感器工作过程中,电解质溶液中硫酸的浓度减小
D. 当电路中转移2×10-4 mol电子时,传感器内参加反应的HCHO为3.0 mg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,中国科学院大连化物所“CO2催化转化为CO的研究”获得新进展。如图是使用不同催化剂(NiPc和CoPc)时转化过程中的能量变化,下列说法不合理的是( )
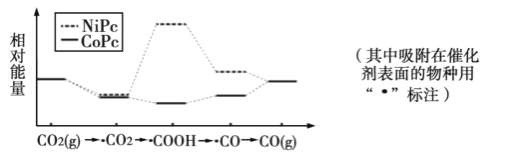
A.CO2经还原反应得到COOH
B.该研究成果将有利于缓解温室效应,并解决能源转化问题
C.相同基团的物种分别吸附在NiPc和CoPc表面,其能量可能不同
D.催化剂可以改变CO2转化为CO反应的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋酸钠(NaBiO3)是分析化学中的重要试剂,在水中缓慢分解,遇沸水或酸则迅速分解。某兴趣小组设计实验制取铋酸钠并探究其应用。回答下列问题:
Ⅰ.制取铋酸钠
制取装置如图(加热和夹持仪器已略去),部分物质性质如下:
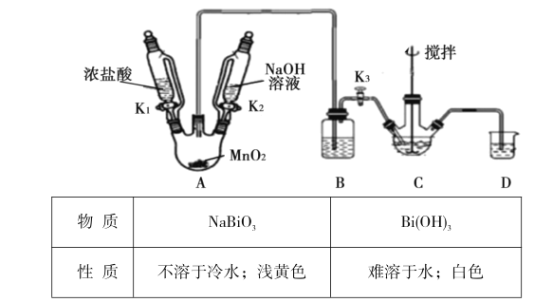
(1)C中盛放Bi(OH)3与NaOH的混合物,与Cl2反应生成NaBiO3,反应的化学方程式为__。B装置的作用是__。
(2)当观察到__(填现象)时,可以初步判断C中反应已经完成。
(3)拆除装置前必须先除去残留的Cl2,以免污染空气。除去烧瓶A中残留Cl2的操作是:关闭__;打开__。
(4)反应结束后,为从装置C中获得尽可能多的产品,需要的操作有_。
Ⅱ.铋酸钠的应用——检验Mn2+
(5)往待检液中加入铋酸钠晶体,加硫酸酸化,生成Bi3+,且溶液变为紫红色,证明待检液中存在Mn2+。产生紫红色现象的离子方程式为__。
Ⅲ.产品纯度的测定
(6)取上述NaBiO3产品ag,加入足量稀硫酸和MnSO4稀溶液使其完全反应,再用bmo1L-1的H2C2O4标准溶液滴定生成的MnO4-(已知:H2C2O4+MnO4-—CO2+Mn2++H2O,未配平),当溶液紫红色恰好褪去时,消耗cmL标准溶液。该产品的纯度为__(用含a、b、c的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨技术的创立开辟了人工固氮的重要途径,解决了亿万人口生存问题。
回答下列问题:
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。

由图可知合成氨反应N2(g)+3H2(g)![]() 2NH3(g)的H=___kJmol-1。该历程中速率最快的一步的活化能(E)为__kJmol-1。
2NH3(g)的H=___kJmol-1。该历程中速率最快的一步的活化能(E)为__kJmol-1。
(2)工业合成氨反应为:N2(g)+3H2(g)![]() 2NH3(g),当进料体积比V(N2)∶V(H2)=1∶3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:
2NH3(g),当进料体积比V(N2)∶V(H2)=1∶3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:

①500℃时,反应的平衡常数Kp(100MPa)__Kp(30MPa)。(填“<”、“=”、“>”)
②500℃、30MPa时,氢气的平衡转化率为__(保留3位有效数字),Kp=__(MPa)-2(列出计算式)。
[Kp为平衡分压代替平衡浓度计算求得的平衡常数(分压=总压×物质的量分数)]
(3)科学家利用电解法在常温常压下合成氨,工作时阴极区的微观示意图如图,其中电解液为溶解有三氟甲磺酸锂和乙醇的惰性有机溶剂。

①阴极区生成NH3的电极反应式为___。
②下列说法正确的是__(填标号)。
A.该装置用金(Au)作催化剂,目的是降低N2的键能
B.三氟甲磺酸锂的作用是增强导电性
C.选择性透过膜可允许N2和NH3通过,防止H2O进入装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳跟浓硫酸共热产生的气体X和铜跟浓硝酸反应产生的气体Y同时通入盛有足量氯化钡溶液的洗气瓶中(如图装置),下列有关说法正确的是( )
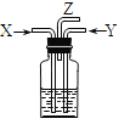
A.洗气瓶中产生的沉淀是碳酸钡
B.洗气瓶中产生的沉淀是硫酸钡
C.在Z导管出来的气体中没有二氧化碳
D.在Z导管口排出无色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“达芦那韦”是抗击新型冠状病毒潜在用药,化合物Qs是它的合成中间体,其合成路线如图:
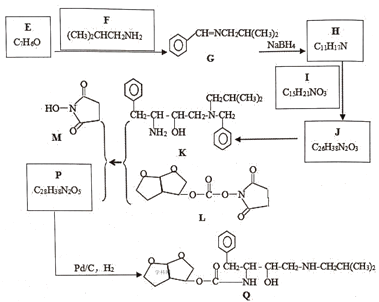
已知:R1CHO![]() R1—CH=N—R2
R1—CH=N—R2
(1)下列说法不正确的是__。
A.有机物E所有原子一定共平面
B.核磁共振、质谱、红外光谱等可用于测定有机物I的结构
C.H→J是加成反应
D.有机物Q分子式C21H33N2O5
(2)写出化合物H的结构简式__。
(3)写出K+L=M+P的化学方程式__。
(4)设计从苯甲醇和CH3NH2为原料制备![]() 的合成路线用流程图表示,无机试剂任选)__。
的合成路线用流程图表示,无机试剂任选)__。
(5)有机物R是相对分子质量比F大14的同系物。R的1H—NMR谱表明分子中有3种氢原子,写出R符合条件的所有同分异构体的结构简式__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com