
【题目】合成氨技术的创立开辟了人工固氮的重要途径,解决了亿万人口生存问题。
回答下列问题:
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。

由图可知合成氨反应N2(g)+3H2(g)![]() 2NH3(g)的H=___kJmol-1。该历程中速率最快的一步的活化能(E)为__kJmol-1。
2NH3(g)的H=___kJmol-1。该历程中速率最快的一步的活化能(E)为__kJmol-1。
(2)工业合成氨反应为:N2(g)+3H2(g)![]() 2NH3(g),当进料体积比V(N2)∶V(H2)=1∶3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:
2NH3(g),当进料体积比V(N2)∶V(H2)=1∶3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:

①500℃时,反应的平衡常数Kp(100MPa)__Kp(30MPa)。(填“<”、“=”、“>”)
②500℃、30MPa时,氢气的平衡转化率为__(保留3位有效数字),Kp=__(MPa)-2(列出计算式)。
[Kp为平衡分压代替平衡浓度计算求得的平衡常数(分压=总压×物质的量分数)]
(3)科学家利用电解法在常温常压下合成氨,工作时阴极区的微观示意图如图,其中电解液为溶解有三氟甲磺酸锂和乙醇的惰性有机溶剂。

①阴极区生成NH3的电极反应式为___。
②下列说法正确的是__(填标号)。
A.该装置用金(Au)作催化剂,目的是降低N2的键能
B.三氟甲磺酸锂的作用是增强导电性
C.选择性透过膜可允许N2和NH3通过,防止H2O进入装置
【答案】-92 17 = 33.3% ![]() N2+6e-+6C2H5OH=2NH3+6C2H5O- BC
N2+6e-+6C2H5OH=2NH3+6C2H5O- BC
【解析】
(1)利用盖斯定律,起点为氮气和氢气,终点为氨气,计算反应焓变;
(2)根据平衡常数定律和公式进行计算;
(3)从图上观察,阴极区氮气与乙醇反应生成氨气和C2H5O-。
(1)由图可知,合成氨反应N2(g)+3H2(g)![]() 2NH3(g)的H=生成物总能量-反应物总能量=
2NH3(g)的H=生成物总能量-反应物总能量=![]() kJmol-1。该历程中速率最快的反应,即吸热最少的反应,活化能(E)为17kJmol-1。
kJmol-1。该历程中速率最快的反应,即吸热最少的反应,活化能(E)为17kJmol-1。
(2)①由平衡常数定义可知,500℃时,温度恒定,相同可逆反应,反应的平衡常数不变,Kp(100MPa) =Kp(30MPa)。
②500℃、30MPa时,氨气的物质的量分数为20%,在恒温恒压时,物质的量之比与体积之比相同,即进料体积比V(N2)∶V(H2)=1∶3,可假设N2加入了1mol,H2加入了3mol,平衡转化了xmol氮气:
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
反应前 1 3 0
变化量 x 3x 2x
平衡时 1-x 3-3x 2x
氨气的物质的量分数=![]() =20%。即x=
=20%。即x=![]() mol,氢气的平衡转化率为=33.3%;平衡时,氮气和氨气的物质的量一致,即物质的量分数均为20%,氢气为60%,Kp=
mol,氢气的平衡转化率为=33.3%;平衡时,氮气和氨气的物质的量一致,即物质的量分数均为20%,氢气为60%,Kp=![]() =
=![]() (MPa)-2。
(MPa)-2。
(3)①根据电解池原理,氮气与乙醇得电子生成氨气,阴极区生成NH3的电极反应式为N2+6e-+6C2H5OH=2NH3+6C2H5O-。
②A.该装置用金(Au)作催化剂,目的是降低反应活化能,不能降低N2的键能,A错误;
B.从阴极反应看,三氟甲磺酸锂并未参加反应,作用是增强导电性,B正确;
C.从图中可知,选择性透过膜可允许N2和NH3通过,防止H2O进入装置,C正确;
答案为BC。


科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu组成的原电池示意图,某小组做完该实验后,在读书卡片上记录如下,卡片上描述合理的是( )
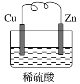
实验记录:
①导线中电流方向:Zn→Cu
②Cu极上有气泡产生,发生还原反应
③锌片变薄
实验结论:
④Zn为正极,Cu为负极
⑤正极反应式:Cu-2e-=Cu2+,发生氧化反应
⑥H+向Cu极移动,SO42-向Zn极移动
A.②③⑥B.④⑤⑥
C.③④⑤D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,石灰乳悬浊液中存在下列平衡:Ca(OH)2(s) ![]() Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,始终保持温度不变,则下列说法正确的是
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,始终保持温度不变,则下列说法正确的是
A. n(OH-)增大B. n(Ca2+)增大C. c(Ca2+)不变D. c(H+)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性小组为探究铜丝与过量浓硫酸的反应,设计了如图所示装置进行有关实验,最后发现试管中铜有剩余。请回答:
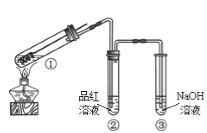
(1)试管①中发生反应的化学方程式是 ________,该反应体现了浓硫酸的______(填“氧化性”或“还原性”)。
(2)试管②中的实验现象是______________。
(3)试管③中,NaOH的作用是____________。反应的化学方程式是______。
(4)该小组认为还应有一定的硫酸剩余,请说明铜丝未完全溶解并仍有一定量余酸的原因_______。
(5)为证明反应结束后的试管中确实有余酸,可选用下列药品中的______________ 。
A.锌粒 B.BaCl2溶液 C.银粉 D.Na2CO3溶液
(6)若想使铜继续反应可以向试管①中加入一种物质,该物质可能是_______(填序号)
A.NaNO3 B. Na2SO4 C. NaCl D.FeCl2
试写出该反应的离子方程式____________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前高铁酸钠(Na2FeO4)被广泛应用于水的处理,具有高效、无毒的优点。某地海水样品经Na2FeO4处理后,所含离子及其浓度见下表(H+和OH-浓度小,未列出):
离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
浓度/(mol·L-1) | a | 0.05 | 0.10 | 0.50 | 0.56 |
常温下,取一定量经Na2FeO4处理过的海水为原料制备精制食盐水和MgCl2·7H2O,过程如下:
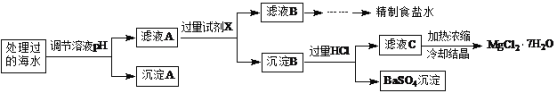
注:离子的浓度小于1.0×10-5 mol·L-1,可认为该离子不存在;Ksp[Fe(OH)3]=1.0×10-38,Ksp[Mg(OH)2]=5.0×10-12;操作过程中溶液体积的变化忽略不计。
(1)根据表中列出的离子浓度计算a=________。沉淀A是_______(填化学式)。
(2)在调节溶液pH时,理论上应调节的pH范围是_______;加入的过量试剂X为_______(填化学式)。
(3)加入过量HCl的作用为___________。
(4)用Fe作阳极、Cu作阴极,电解NaOH溶液可制得Na2FeO4,则电解过程中阳极的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用18mol/L 浓硫酸配制100 ml 3.0mol/L 稀硫酸的实验步骤如下:
① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 溶解
④ 转移、洗涤 ⑤ 定容、摇匀
回答下列问题:
(1)所需浓硫酸的体积是 mL ,量取浓硫酸所用的量筒的规格是 。
(从下列中选用 A. 10mL B. 25mL C. 50mL D. 100ml)
(2)第③步实验的操作是
。
(3)第⑤步实验的操作是
。
(4)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A. 所用的浓硫酸长时间放置在密封不好的容器中
B. 容量瓶用蒸馏水洗涤后残留有少量的水
C. 所用过的烧杯、玻璃棒未洗涤
D. 定容时俯视溶液的液凹面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖授予了约翰古迪纳夫等三位科学家,以表彰他们在锂离子电池研发领域作出的贡献。某充电宝锂离子电池的总反应为:xLi++Li1-xMn2O4![]() LiMn2O4,某手机镍氢电池的总反应为:NiOOH+MH
LiMn2O4,某手机镍氢电池的总反应为:NiOOH+MH![]() M+Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是( )
M+Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是( )
A.锂离子电池充电时Li+向阴极迁移
B.如图表示用锂离子电池给镍氢电池充电
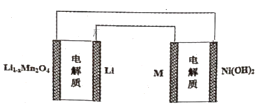
C.镍氢电池充电时,阴极的电极反应式:H2O+M+e-=MH+OH-,H2O中的H被M还原
D.锂离子电池放电时,正极的电极反应式:Li1-xMn2O4+xLi++xe-=LiMn2O4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2在一定条件下可以合成乙醇(CH3CH2OH):2CO(g)+4H2(g) ![]() CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
A. CO全部转化为乙醇
B. 正反应和逆反应的化学反应速率均为零
C. 反应体系中乙醇的物质的量浓度不再变化
D. CO和H2以1:2的物质的量之比反应生成乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物 ![]() 和
和 ![]() 的说法正确的是( )
的说法正确的是( )
A. 一氯代物数目均有6种
B. 二者均能发生取代、加成和氧化反应
C. 可用酸性高锰酸钾溶液区分
D. ![]() 分子中所有碳原子可能在同一平面上
分子中所有碳原子可能在同一平面上
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com