
【题目】目前高铁酸钠(Na2FeO4)被广泛应用于水的处理,具有高效、无毒的优点。某地海水样品经Na2FeO4处理后,所含离子及其浓度见下表(H+和OH-浓度小,未列出):
离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
浓度/(mol·L-1) | a | 0.05 | 0.10 | 0.50 | 0.56 |
常温下,取一定量经Na2FeO4处理过的海水为原料制备精制食盐水和MgCl2·7H2O,过程如下:
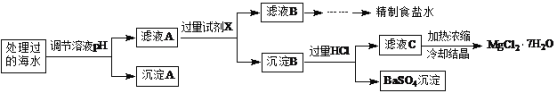
注:离子的浓度小于1.0×10-5 mol·L-1,可认为该离子不存在;Ksp[Fe(OH)3]=1.0×10-38,Ksp[Mg(OH)2]=5.0×10-12;操作过程中溶液体积的变化忽略不计。
(1)根据表中列出的离子浓度计算a=________。沉淀A是_______(填化学式)。
(2)在调节溶液pH时,理论上应调节的pH范围是_______;加入的过量试剂X为_______(填化学式)。
(3)加入过量HCl的作用为___________。
(4)用Fe作阳极、Cu作阴极,电解NaOH溶液可制得Na2FeO4,则电解过程中阳极的电极反应式为___________。
【答案】0.17 Fe(OH)3 3<pH<9 Ba(OH)2 使Mg(OH)2全部转化为MgCl2;抑制Mg2+水解 Fe-6e-+8OH-=FeO42-+4H2O
【解析】
根据电荷守恒计算溶液中离子浓度大小;根据溶度积计算完全沉淀时溶液的pH;根据盐类的水解原理分析易水解盐类的制备流程;根据电解原理书写相关电极方程式。
(1)H+和OH-浓度小,可以忽略,根据表中离子浓度大小,利用电荷守恒可知:2c(SO42-)+c(Cl-)=2c(Mg2+)+3c(Fe3+)+c(Na+),即2a+0.56=2×0.05+3×0.1+0.5,则a=0.17;
由工艺流程图可知,处理的海水调节pH值,目的是Fe3+将转化为Fe(OH)3,除去溶液中的Fe3+,故沉淀A的组成为Fe(OH)3;
(2)Mg2+完全沉淀时c(OH-)=10-5mol/L,pH值为9,Fe3+完全沉淀时c(OH-)=10-11mol/L,pH值为3,在调节溶液pH时,应当使3<pH<9;由工艺流程图可知,加入的过量试剂X目的是使滤液A中的SO42-转化为沉淀,Mg2+转化为Mg(OH)2,用钡离子沉淀SO42-,氢氧根沉淀Mg2+,故试剂X为Ba(OH)2;
(3)由工艺流程图可知,加入过量盐酸使Mg(OH)2全部溶解转化为MgCl2,在加热浓缩滤液C时Mg2+水解,HCl的作用为抑制Mg2+水解;
(4)电解过程中阳极失去电子,发生氧化反应,活泼金属铁作阳极,失去电子,生成FeO42-,电解质溶液为NaOH,则电极反应式为Fe-6e-+8OH-=FeO42-+4H2O。


科目:高中化学 来源: 题型:
【题目】地球的表面积为5.1亿平方公里,其中海洋的面积为3.67亿平方公里,占整个地球表面积的70.8 %。海洋是一个巨大的化学资源宝库,下面是海水资源综合利用的部分流程图,请根据该图回答下列问题:
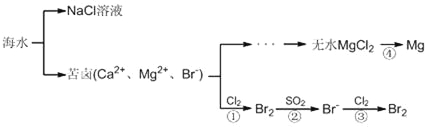
(1)淡化海水的方法有__________________(写一种合理方法即可)。由海水提取的粗盐中含有Ca2+、Mg2+、SO42-等离子,为了除去这些离子,需要依次加入稍过量的NaOH、BaCl2、________(填化学式),之后________(填操作名称),再加入适量________(填试剂名称)。将所得溶液加热浓缩、冷却结晶,得到精盐。
(2)反应④由无水MgCl2制取金属镁的常用工业方法是__________________。
(3)向苦卤中通入Cl2置换出Br2,再用空气吹出溴并用SO2吸收,转化为Br-,反复多次,以达到富集溴的目的。由海水提溴过程中的反应可得出Cl-、SO2、Br-还原性由强到弱的顺序是_________________________。
(4)工业上也可以用Na2CO3溶液吸收吹出的Br2,生成溴化钠和溴酸钠,同时放出CO2。写出反应的离子方程式__________________________________。最后再用H2SO4处理所得溶液重新得到Br2,其反应的离子方程式为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明,氮氧化物(NOx)和二氧化硫在形成雾霾时与大气中的氨有关,其转化关系如下图所示。
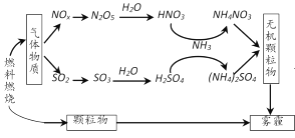
下列关于雾霾及其形成的叙述中,不正确的是
A.与燃料燃烧有关
B.涉及氧化还原反应
C.NH3是形成无机颗粒物的催化剂
D.雾霾中含有NH4NO3和(NH4)2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近,中国科学院大连化物所“CO2催化转化为CO的研究”获得新进展。如图是使用不同催化剂(NiPc和CoPc)时转化过程中的能量变化,下列说法不合理的是( )
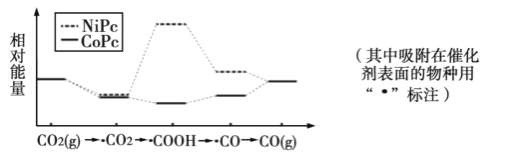
A.CO2经还原反应得到COOH
B.该研究成果将有利于缓解温室效应,并解决能源转化问题
C.相同基团的物种分别吸附在NiPc和CoPc表面,其能量可能不同
D.催化剂可以改变CO2转化为CO反应的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两同学用下图所示装置进行实验,探究硝酸与铁反应的产物。
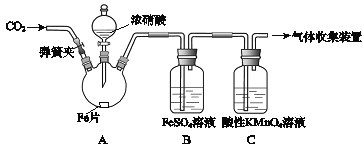
文献记载:
I.在浓硝酸和活泼金属反应过程中,随着硝酸浓度的降低,其生成的产物有+4、+2、﹣3价等氮的化合物。
II.FeSO4+NOFe(NO)SO4(棕色) 。
III.NO2和NO都能被KMnO4氧化吸收。
甲的实验操作和现象记录如下:
实验操作 | 实验现象 |
(1)打开弹簧夹,通入一段时间某气体,关闭弹簧夹。 | |
(2)打开分液漏斗活塞,将浓硝酸缓慢滴入烧瓶中,关闭活塞。 | 无明显现象。 |
(3)加热烧瓶,反应开始后停止加热。 | ①A中有红棕色气体产生,一段时间后,气体颜色逐渐变浅; B中溶液变棕色; C中溶液紫色变浅。 ②反应停止后,A中有固体剩余。 |
请回答下列问题:
(1)为排除空气对实验的干扰,操作(1)中通入的气体可能是________________。
(2)滴入浓硝酸加热前没有明显现象的原因是__________________________。
(3)试写出加热烧瓶后A中有红棕色气体产生的化学方程式_______________。
(4)甲认为B中溶液变棕色是因为A中有NO生成,你认为甲的观点对吗_________(填正确或错误)?请结合方程式简述原因 ________________________________。
(5)检验是否生成﹣3价氮的化合物,应进行的实验操作是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨技术的创立开辟了人工固氮的重要途径,解决了亿万人口生存问题。
回答下列问题:
(1)科学家研究利用铁触媒催化合成氨的反应历程如图所示,其中吸附在催化剂表面的物种用“ad”表示。

由图可知合成氨反应N2(g)+3H2(g)![]() 2NH3(g)的H=___kJmol-1。该历程中速率最快的一步的活化能(E)为__kJmol-1。
2NH3(g)的H=___kJmol-1。该历程中速率最快的一步的活化能(E)为__kJmol-1。
(2)工业合成氨反应为:N2(g)+3H2(g)![]() 2NH3(g),当进料体积比V(N2)∶V(H2)=1∶3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:
2NH3(g),当进料体积比V(N2)∶V(H2)=1∶3时,平衡气体中NH3的物质的量分数随温度和压强变化的关系如图所示:

①500℃时,反应的平衡常数Kp(100MPa)__Kp(30MPa)。(填“<”、“=”、“>”)
②500℃、30MPa时,氢气的平衡转化率为__(保留3位有效数字),Kp=__(MPa)-2(列出计算式)。
[Kp为平衡分压代替平衡浓度计算求得的平衡常数(分压=总压×物质的量分数)]
(3)科学家利用电解法在常温常压下合成氨,工作时阴极区的微观示意图如图,其中电解液为溶解有三氟甲磺酸锂和乙醇的惰性有机溶剂。

①阴极区生成NH3的电极反应式为___。
②下列说法正确的是__(填标号)。
A.该装置用金(Au)作催化剂,目的是降低N2的键能
B.三氟甲磺酸锂的作用是增强导电性
C.选择性透过膜可允许N2和NH3通过,防止H2O进入装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图点滴板上进行四个溶液间反应的小实验,其对应反应的离子方程式书写正确的是( )

A. a反应:Fe2++2H++H2O2=Fe3++2H2O
B. b反应:HCO3-+OH-=CO32-+H2O
C. c反应:H++OH-=H2O
D. d反应:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关铜与过量浓硫酸反应的实验说法不正确的是( )
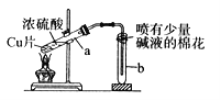
A. 喷有碱液的棉花是为了防止SO2污染环境
B. 将水注入反应后冷却的试管a中,溶液变为蓝色
C. 铜片表面先发黑,反应完全后试管a底部有白色固体
D. 反应的化学方程式是Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁是中学化学常见物质,它们有如图转化关系(反应条件和其它产物省略),有关描述错误的是
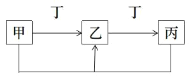
A.若甲为氢氧化钠溶液,则丁可能为二氧化碳
B.若乙为淡黄色固体,则丙一定为二氧化硫
C.若乙为两性氢氧化物,则丁溶液可能碱性
D.若丁是铁单质,则甲一定为氯气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com