
����Ŀ���ס�����ͬѧ����ͼ��ʾװ�ý���ʵ�飬̽������������Ӧ�IJ��
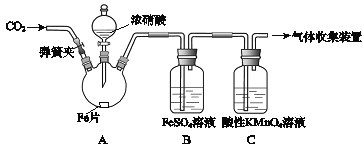
�����أ�
I����Ũ����ͻ��ý�����Ӧ�����У���������Ũ�ȵĽ��ͣ������ɵIJ�����+4��+2����3�۵ȵ��Ļ����
II��FeSO4+NOFe(NO)SO4(��ɫ) ��
III��NO2��NO���ܱ�KMnO4�������ա�
��ʵ������������¼���£�
ʵ����� | ʵ������ |
(1)���ɼУ�ͨ��һ��ʱ��ij���壬�رյ��ɼС� | |
(2)��Һ©����������Ũ���Ỻ��������ƿ�У��رջ����� | ���������� |
(3)������ƿ����Ӧ��ʼ��ֹͣ���ȡ� | ��A���к���ɫ���������һ��ʱ���������ɫ��dz�� B����Һ����ɫ�� C����Һ��ɫ��dz�� �ڷ�Ӧֹͣ��A���й���ʣ�ࡣ |
��ش��������⣺
(1)Ϊ�ų�������ʵ��ĸ��ţ�����(1)��ͨ������������________________��
(2)����Ũ�������ǰû�����������ԭ����__________________________��
(3)��д��������ƿ��A���к���ɫ��������Ļ�ѧ����ʽ_______________��
(4)����ΪB����Һ����ɫ����ΪA����NO���ɣ�����Ϊ�Ĺ۵����_________(����ȷ�����)�����Ϸ���ʽ����ԭ�� ________________________________��
(5)�����Ƿ����ɩ�3�۵��Ļ����Ӧ���е�ʵ�������________________________��
���𰸡�N2��CO2(�����������̼)�� ����������Ũ�����жۻ� Fe+6HNO3![]() Fe(NO)3+3NO2��+3H2O ���� 3NO2+H2O=2HNO3+NO���÷�Ӧ���ɵ�һ����������FeSO4����ɫ ȡA��Һ���������Թ��У�����Ũ����������Һ�����ȣ���ʪ��ĺ�ɫʯ����ֽ�����ܿڣ���������֤����������Σ�����û���������
Fe(NO)3+3NO2��+3H2O ���� 3NO2+H2O=2HNO3+NO���÷�Ӧ���ɵ�һ����������FeSO4����ɫ ȡA��Һ���������Թ��У�����Ũ����������Һ�����ȣ���ʪ��ĺ�ɫʯ����ֽ�����ܿڣ���������֤����������Σ�����û���������
��������
(1)Ϊ�ų�������ʵ��ĸ��ţ�����(1)��ͨ�����������ǵ����������̼��
(2)����ʱ������Ũ�����γ���������Ĥ����ֹ��Ӧ��һ��������
(3)Ũ���������ڼ��������·�Ӧ����������������������ˮ��
(4)����������ˮ��Ӧ���������һ�����������ɵ������ܽ�������������Ϊ������ʹ��Һ��Ϊ��ɫ��ͬʱ�����֪��Ϣ�����ɵ�һ������Ҳ����������������Ӧת��ΪFe(NO)SO4����ɫ��
(5) ����-3�۵��Ļ��������ɣ�Ӧ����NH4+������A��Һ���Ƿ���NH4+���Ӽ��ɡ�
(1)Ϊ�ų�������ʵ��ĸ��ţ�����(1)��ͨ������������N2��CO2(�����������̼)�ȣ�
(2)����ʱ������Ũ���ᷴӦ����һ�����ܵ������ﱡĤ����ֹ������Ũ�����һ����Ӧ���������ۻ��������Ե���Ũ�������ǰû����������
(3)Ũ���������ڼ��������·�Ӧ����������������������ˮ����ѧ����ʽFe+6HNO3![]() Fe(NO)3+3NO2��+3H2O��
Fe(NO)3+3NO2��+3H2O��
(4)����ΪB����Һ����ɫ����ΪA����NO���ɣ��Ĺ۵����3NO2+H2O=2HNO3+NO�������֪��ϢII���÷�Ӧ���ɵ�һ����������FeSO4����ɫ��
(5)����3�۵��Ļ������ǰ���,������������ˮ���ɰ�ˮ����ˮ��������笠����ӣ�����笠����ӵķ����ǣ�ȡ������Ӧ��A����Һ���Թ��У������м���ŨNaOH��Һ�����ȣ���ʪ��ĺ�ɫʯ����ֽ�ӽ��Թܿڣ�����ֽ��������A������NH4+������û��������Ρ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)2mol O3��3mo lO2������֮��Ϊ��_____��������֮��Ϊ��_______ ��ͬ��ͬѹ�µ��ܶ�֮��Ϊ��____________��
(2)����9 g D2O ���������ӵ�������ֵ��NA��ʾ�������ʵ������ʵ���Ϊ��______������������Ϊ��_____ �� ����������Ϊ��__________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ���ԭ���ķ��������ܺ��ܼ����ľ������ͼ��ʾԭ��ص�˵����ȷ����
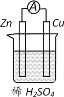
A.���Ӿ�пƬ����ͭƬ
B.Cu������Zn����
C.��װ���ܽ�����ת��Ϊ��ѧ��
D.пƬ�Ϸ����ķ�ӦΪ 2H++2e-=H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ɳ���صij䡢�ŵ練Ӧ����ʽ���У�Cd��2NiO(OH)��2H2O![]() Cd(OH)2��2Ni(OH)2���ɴ��жϣ�����˵���������
Cd(OH)2��2Ni(OH)2���ɴ��жϣ�����˵���������
A. �ŵ�ʱ��NiO(OH)������
B. �ŵ�ʱ��Cd������ԭ��Ӧ
C. �������ҺΪ������Һ
D. ���ʱ��������ӦΪNi(OH)2��OH����e��== NiO(OH)��H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���25 mL 0.1 mol��L-1NaOH��Һ����εμ�0.2 mol��L-1��HN3�������ᣩ��Һ��pH�ı仯������ͼ��ʾ����Һ���ʱ����ı仯���Բ��ƣ��������Ka=10-4.7��������˵����ȷ����
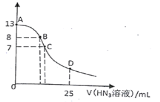
A. 0.1 mol��L-1 NaN3��ҺpHԼΪ8.85
B. ��B�㣬����Ũ�ȴ�СΪc(OH��)>c(H+)>c (Na+)>c(N3��)
C. ��C�㣬�μӵ�V(HN3)<12.5 mL
D. ��D�㣬c(Na+)=2c(HN3)+2 c(N3��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ŀǰ�������ƣ�Na2FeO4�����㷺Ӧ����ˮ�Ĵ��������и�Ч�������ŵ㡣ij�غ�ˮ��Ʒ��Na2FeO4�������������Ӽ���Ũ�ȼ��±���H����OH��Ũ��С��δ�г�����
���� | SO42- | Mg2+ | Fe3+ | Na+ | Cl�� |
Ũ��/(mol��L-1) | a | 0.05 | 0.10 | 0.50 | 0.56 |
�����£�ȡһ������Na2FeO4�������ĺ�ˮΪԭ���Ʊ�����ʳ��ˮ��MgCl2��7H2O���������£�
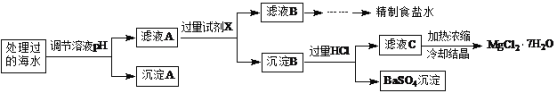
ע�����ӵ�Ũ��С��1.0��10-5 mol��L-1������Ϊ�����Ӳ����ڣ�Ksp[Fe(OH)3]��1.0��10-38��Ksp[Mg(OH)2]��5.0��10-12��������������Һ����ı仯���Բ��ơ�
��1�����ݱ����г�������Ũ�ȼ���a��________������A��_______���ѧʽ����
��2���ڵ�����ҺpHʱ��������Ӧ���ڵ�pH��Χ��_______������Ĺ����Լ�XΪ_______���ѧʽ����
��3���������HCl������Ϊ___________��
��4����Fe��������Cu�����������NaOH��Һ���Ƶ�Na2FeO4����������������ĵ缫��ӦʽΪ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ̼���ƣ�����ԼΪ98%���г�����Ca2+��Mg2+��Fe3+��Cl-��S![]() ������,Ϊ���ᴿ��ҵ̼����,������Լ���̼���Ƶļ�Ҫ����������ͼ:
������,Ϊ���ᴿ��ҵ̼����,������Լ���̼���Ƶļ�Ҫ����������ͼ:

��֪:̼���Ƶı�����Һ�ڲ�ͬ�¶���������������ͼ��ʾ:
![]()
��1���ȵ�Na2CO3��Һ�н�ǿ��ȥ��������,��ԭ���ǣ������ӷ���ʽ����Ҫ�����ּ��Խ���______��
��2�������ȹ�����ʱ���¶�Ӧ������______��
��3����֪:Na2CO3��10H2O��s��=Na2CO3��s��+10H2O��g������H=+532.36 kJ�� mol-1
Na2CO3��10H2O��s��=Na2CO3��H2O��s��+9H2O��g������H=+473.63kJ�� mol-1
д��Na2CO3��H2O��ˮ��Ӧ���Ȼ�ѧ����ʽ:_____________��
��4�����˴�����ɫ��ѧ���Ƕ����뽫��ĸҺ��������ͼ��������ʾ����ѭ��ʹ��,�������ʵ���������Ƿ����:______,��������____________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӵ�������ֵΪNA��ʵ�����Ʊ�����(N2H4)�Ļ�ѧ����ʽΪ:2NH3 +NaClO=N2H4 +NaCl+ H2O������˵����ȷ����
A. 0. lmolN2H4������������Ϊ1. 8NA
B. 0. 1mol��L-1��NaClO��Һ�У�ClO-������Ϊ0.1NA
C. ����4.48LNH3ʱ��ת�Ƶ�����Ϊ0.2NA
D. 1.6g N2H4�д��ڹ��ۼ�����Ϊ0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�ⶨij��Ʒ�з�Ԫ�ص�����������������ʵ�飬���ø�����(�߷е���)����Ʒ�еķ�Ԫ��ת��Ϊ������(�����Ϊ�ͷе��ᣬ�����ͣ������ǶԲ��������ĸ�ʴ)����ˮ������������ͨ���ζ�������ʵ��װ������ͼ��ʾ������װ��ʡ�ԡ�
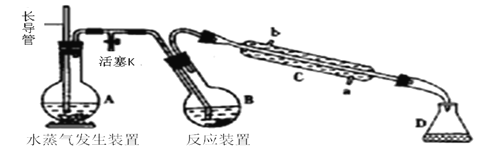
(1) ����C������___________��������������_____________________________��
(2)ʵ��ʱ�����ȴ���K����ˮ����ʱ���رջ���K����ʼ����������ʱ��Ӧװ�þֲ�������ɳ�����ˮλ����������Ӧ����______________________��
(3)����ˮ��������װ�úͷ�Ӧװ��֮��IJ����ܳ�����ʯ��������������________��
(4)B�м���һ������������1.00g ����ϡ��������D��ʢ�еμӷ�̪��NaOH��Һ������A��B��ʹA�в�����ˮ��������B��
���������ʲ��ɴ�����������___________(����)
a. ���� b.���� c.���� d.���� e.����
��D����Ҫ��Ӧ�����ӷ���ʽΪ_________________________________��
(5)�����Һ�м���25.00mL0.1000mol��L��1La(NO3)3��Һ���õ�LaF3����(La3+������������Ӧ)������0.1000 mol�� L��1EDTA����Һ�ζ�ʣ��La3+(La3+��EDTA��1�U1������Ϸ�Ӧ)������EDTA����Һƽ��19.80mL�������ϡ����Ʒ�з�����������Ϊ______(�ٷ�������С�������λ)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com