
【题目】阿伏加德罗常数的值为NA,实验室制备联氨(N2H4)的化学方程式为:2NH3 +NaClO=N2H4 +NaCl+ H2O。下列说法正确的是
A. 0. lmolN2H4中所含质子数为1. 8NA
B. 0. 1mol·L-1的NaClO溶液中,ClO-的数量为0.1NA
C. 消耗4.48LNH3时,转移电子数为0.2NA
D. 1.6g N2H4中存在共价键总数为0.2NA
【答案】A
【解析】分析:A. 1个N2H4中含有(2×7+4×1)=18个质子;B.根据c=![]() 分析判断;C. 气体的体积与温度和压强有关;D.1个N2H4中存在1个N-N键和4个N-H键。
分析判断;C. 气体的体积与温度和压强有关;D.1个N2H4中存在1个N-N键和4个N-H键。
详解:A. 1个N2H4中含有(2×7+4×1)=18个质子,则0. lmolN2H4中所含质子数为1. 8NA,故A正确;B. 未告知0. 1mol·L-1的NaClO溶液的体积,无法计算ClO-的数量,故B错误;C. 为告知气体的状态,无法计算4.48LNH3的物质的量,故C错误;D.1个N2H4中存在1个N-N键和4个N-H键,1.6g N2H4的物质的量=![]() =0.05mol,存在共价键0.05mol×5=0.25mol,故D错误;故选A。
=0.05mol,存在共价键0.05mol×5=0.25mol,故D错误;故选A。


科目:高中化学 来源: 题型:
【题目】下列热化学式中,正确的是( )
A. 甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g);△H=-890.3kJ·mol-1
B. 500℃、30MPa下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:
N2+3H2(g)![]() 2NH3(g);△H=-38.6kJ·mol-1
2NH3(g);△H=-38.6kJ·mol-1
C. 稀盐酸和稀氢氧化钠溶液混合,其热化学方程式为:H+(aq)+OH-(aq)=H2O(1); △H=-57.3kJ·mol-1
D. 1molH2完全燃烧放热142.9kJ,则氢气燃烧的热化学方程式为:2H2(g)+O2(g)=2H2O(1);△H=+285.8kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能用勒夏特列原理解释的是( )
A. 铁在潮湿的空气中易腐蚀
B. H2、I2、HI平衡混和气加压后颜色变深
C. 往往需要在催化剂条件下SO2氧化成SO3
D. 棕红色NO2加压后颜色先变深后变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组探究Na2CO3和NaHCO3的性质,实验步骤及记录如下:
Ⅰ.分别向盛有0.5 g Na2CO3固体、0.5 g NaHCO3固体的烧杯中加入10 mL水(20 ℃),搅拌,测量温度为T1;
Ⅱ.静置恒温后测量温度为T2;
Ⅲ.分别加入10 mL 密度约为1.1 g·mL-120%的盐酸(20 ℃),搅拌,测量温度T3。
得到下表1的数据:
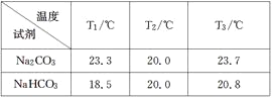
回答下列问题:
(1)Na2CO3溶于水显碱性,其原因是______________________(用离子方程式表示)。
(2)根据试题后的附表判断:步骤Ⅰ中Na2CO3、NaHCO3固体分别是全部溶解还是部分溶解____________________________________。
(3)分析表1的数据得出:Na2CO3固体溶于水________,NaHCO3固体溶于水________(填“放热”或“吸热”)。
(4)甲同学分析上述数据得出:Na2CO3和NaHCO3与盐酸反应都是放热反应。
乙同学认为应该增加一个实验,并补做如下实验:向盛有10 mL水(20 ℃)的烧杯中加入10 mL________,搅拌,测量温度为22.2 ℃。
(5)结合上述探究,下列说法正确的是________。
A.NaHCO3与盐酸的反应是吸热反应
B.不能用稀盐酸鉴别Na2CO3和NaHCO3固体
C.Na2CO3、NaHCO3固体与稀盐酸反应的能量变化还与物质的溶解等因素有关
(6)丙同学为测定一份NaHCO3和Na2CO3混合固体中NaHCO3的纯度,称取m1g混合物,加热至质量不变时,称其质量为m2g,则原混合物中NaHCO3的质量分数为________(用代数式表示)。
附表:溶解度表
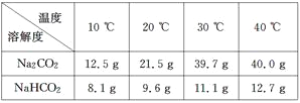 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂(LiCoO2)、导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe- = LixC6。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。

回答下列问题:
(1)LiCoO2中,Co元素的化合价为 。
(2)写出“正极碱浸”中发生反应的离子方程式 。
(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式 ;可用盐酸代替H2SO4和H2O2的混合液,但缺点是 。
(4)写出“沉钴”过程中发生反应的化学方程式 。
(5)充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式 。
(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是 。在整个回收工艺中,可回收到的金属化合物有 (填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】灼热的焦炭与水蒸气反应所得产物为H2、CO和少量CO2,为了检验产物中的H2和CO(设气体均被充分吸收),设计如下实验装置。下列有关说法错误的是
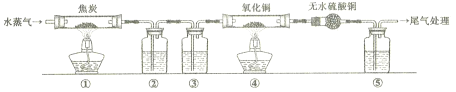
A. 为了实验安全,应先点燃①处酒精灯,后点燃④处酒精灯
B. ②、③、⑤中依次盛装氢氧化钠溶液、浓硫酸和澄清石灰水
C. ④中黑色固体变红色,即可证明产物中一定含有H2和CO中的一种或两种
D. 若用碱石灰替换无水硫酸铜,也可以达到检验H2和CO目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是组成生物体的部分高分子化合物与组成它们的化学元素的关系图:
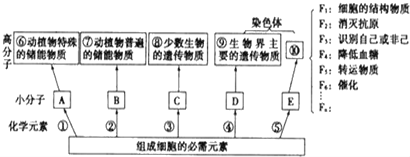
(1)构成小分子A、B、C、D、E的化学元素中,相同的元素有_____.
(2)写出下列高分子的名称:⑦___;⑨_____;⑩ _________.
(3)导致F1~Fn差别的原因是____________________________________.
(4)小分子C和D比较一定不同的是,前者含________,后者含______.
(5)写出下列物质的具体名称:F2为______;F6 为________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中.正确的是( )

A. 常压下五种元素的单质中Z单质的沸点最高
B. Y、Z的阴离子电子层结构都与R原子的相同
C. W的氢化物沸点比X的氢化物的沸点高
D. Y元素的非金属性比W元素的非金属性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com