
【题目】研究表明,氮氧化物(NOx)和二氧化硫在形成雾霾时与大气中的氨有关,其转化关系如下图所示。
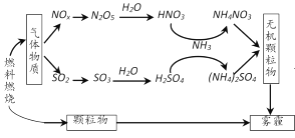
下列关于雾霾及其形成的叙述中,不正确的是
A.与燃料燃烧有关
B.涉及氧化还原反应
C.NH3是形成无机颗粒物的催化剂
D.雾霾中含有NH4NO3和(NH4)2SO4
科目:高中化学 来源: 题型:
【题目】肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如下图所示。已知断裂1 mol化学键所需的能量(kJ):N≡N为942、O=O为500、N—N为154,则断裂1 mol N—H键所需的能量(kJ)是:

A. 194 B. 391 C. 516 D. 658
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:
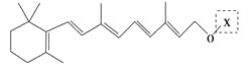
为了研究X的结构,将化合物A在一定条件下水解只得到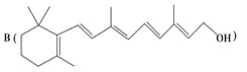 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。
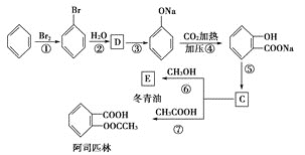
(ⅰ)写出有机物的结构简式:D:______________,C:________________,E:______________。
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)
反应①__________________________________;反应⑥_____________________________。
(ⅲ)变化过程中的②属于____________反应,⑦属于________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中“实验内容”与验应“现象或结论”关系都正确的是
选项 | 实验内容 | 实验现象或结论 |
A | 分别往 4 mL 0.01 mol/L 、4 mL 0.02 mol/L KMnO4溶液加入2 mL 0.1 mol/L H2C2O4 溶液,记录褪色时间 | 浓度越大,反应速率越快越先褪色 |
B | 以石墨为电极,电解 KI溶液 (其中含有少量酚酞) | 阴极逸出气体且附近溶液呈现红色 |
C | 25℃时,向 pH=l 的盐酸和醋酸各 0.5L的溶液中各加入 1.4g 铁粉 | 醋酸中生成H2的速率快且最终气体 量多 |
D | 向 FeCl3+3KSCN | 血红色变浅,说明增加生成物浓度, 平衡逆向移动 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池原理的发现是贮能和供能技术的巨大进步。图所示原电池的说法正确的是
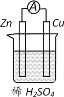
A.电子经锌片流向铜片
B.Cu为负极,Zn为正极
C.该装置能将电能转化为化学能
D.锌片上发生的反应为 2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,石灰乳悬浊液中存在下列平衡:Ca(OH)2(s) ![]() Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,始终保持温度不变,则下列说法正确的是
Ca2+(aq)+2OH-(aq),当向此悬浊液中加入少量生石灰时,始终保持温度不变,则下列说法正确的是
A. n(OH-)增大B. n(Ca2+)增大C. c(Ca2+)不变D. c(H+)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镉镍可充电电池的充、放电反应按下式进行:Cd+2NiO(OH)+2H2O![]() Cd(OH)2+2Ni(OH)2,由此判断,下列说法错误的是
Cd(OH)2+2Ni(OH)2,由此判断,下列说法错误的是
A. 放电时,NiO(OH)作正极
B. 放电时,Cd发生还原反应
C. 电解质溶液为碱性溶液
D. 充电时,阳极反应为Ni(OH)2+OH--e-== NiO(OH)+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前高铁酸钠(Na2FeO4)被广泛应用于水的处理,具有高效、无毒的优点。某地海水样品经Na2FeO4处理后,所含离子及其浓度见下表(H+和OH-浓度小,未列出):
离子 | SO42- | Mg2+ | Fe3+ | Na+ | Cl- |
浓度/(mol·L-1) | a | 0.05 | 0.10 | 0.50 | 0.56 |
常温下,取一定量经Na2FeO4处理过的海水为原料制备精制食盐水和MgCl2·7H2O,过程如下:
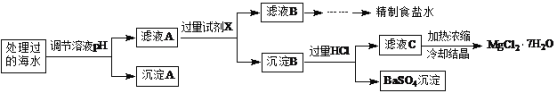
注:离子的浓度小于1.0×10-5 mol·L-1,可认为该离子不存在;Ksp[Fe(OH)3]=1.0×10-38,Ksp[Mg(OH)2]=5.0×10-12;操作过程中溶液体积的变化忽略不计。
(1)根据表中列出的离子浓度计算a=________。沉淀A是_______(填化学式)。
(2)在调节溶液pH时,理论上应调节的pH范围是_______;加入的过量试剂X为_______(填化学式)。
(3)加入过量HCl的作用为___________。
(4)用Fe作阳极、Cu作阴极,电解NaOH溶液可制得Na2FeO4,则电解过程中阳极的电极反应式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)双氧水(H2O2)是一种绿色氧化剂,它的电子式为__。
(2)在常压下,乙醇的沸点(78.2℃)比甲醚的沸点(-23℃)高。主要原因是__。
(3)联氨(又称肼,分子式N2H4)是一种应用广泛的化工原料,可用作火箭燃料。联氨为二元弱碱,在水中的电离方程式与氨相似。
①肼的水溶液显碱性原因是__(请用肼在水中一级电离的方程式来表示)。
②联氨与硫酸形成的酸式盐的化学式为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com