

| A. | 加水稀释至溶液体积为200 mL,醋酸溶液的pH变为4 | |
| B. | 温度都升高20℃后,两溶液的pH不再相等 | |
| C. | 加水稀释至溶液体积为200 mL后,两种溶液中c(OH-)都减小 | |
| D. | 加足量的锌充分反应后,两溶液中产生的氢气体积可用右图表示 |
分析 盐酸是强酸,完全电离,醋酸是弱酸,部分电离,相同温度下,相同pH值的盐酸和醋酸溶液,醋酸浓度大,溶液稀释时,醋酸进一步电离,其溶液中离子浓度大于盐酸的离子浓度,升高温度促进弱酸的电离,氢离子浓度增大.
解答 解:A、对于酸,加水稀释后,溶液的酸性均要减弱,两溶液的pH均增大,稀释至200ml,溶液的浓度变为原来的一半,pH变化小于1个单位,则醋酸溶液的pH<3,故A错误;
B、盐酸是强酸,完全电离,醋酸是弱酸,部分电离,升高温度,醋酸的电离程度增大,所以酸性会增强,pH会减小,则两溶液的pH不再相等,故B正确;
C、对于酸,加水稀释后,溶液的酸性均要减弱,两溶液的pH均增大,则两种溶液中c(OH-)都增大,故C错误;
D、盐酸是强酸,完全电离,醋酸是弱酸,部分电离,相同温度下,相同pH值的盐酸和醋酸溶液,醋酸浓度大,相同体积的两种溶液,加足量的锌充分反应后,醋酸产生的氢气比盐酸多,故D错误.
故选B.
点评 本题考查强弱电解质溶液稀释时的浓度变化,注意加水促进弱电解质电离的特点,题目难度不大.


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:解答题
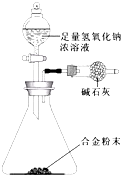 A-F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:请回答下列问题:
A-F六种元素中,除C外其他均为短周期元素,它们的原子结构或性质如下表所示:请回答下列问题:| 元素 | 结构或性质 |
| A | 原子最外层电子数是内层电子总数的$\frac{1}{5}$ |
| B | 形成化合物种类最多的元素,其单质为固体 |
| C | 生活中常见的金属,它有两种常见的氯化物,且相对分子质量相差35.5 |
| D | 地壳中含量最多的元素 |
| E | 与D同主族 |
| F | 与E同周期,且最外层电子数等于电子层数 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧气和臭氧互为同分异构体 | B. | 二氧化碳晶体中存在分子间作用力 | ||
| C. | 1H2O和2H2O互为同位素 | D. | 正丁烷和异丁烷互为同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 510 | 770 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
| A. | 甲组和乙组的实验中,盐酸均是过量的 | |
| B. | 盐酸的物质的量浓度为0.8 mol/L | |
| C. | 合金中镁铝的物质的量之比为1:1 | |
| D. | 丙组中铝的物质的量为0.009 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 物质的结构决定性质,性质反映其结构特点.
物质的结构决定性质,性质反映其结构特点.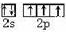 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H8N4 | B. | C6H12N4 | C. | C6H10N4 | D. | C4H8N4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com