
| 实验序号 | 甲 | 乙 | 丙 |
| 合金质量/mg | 510 | 770 | 918 |
| 气体体积/mL | 560 | 672 | 672 |
| A. | 甲组和乙组的实验中,盐酸均是过量的 | |
| B. | 盐酸的物质的量浓度为0.8 mol/L | |
| C. | 合金中镁铝的物质的量之比为1:1 | |
| D. | 丙组中铝的物质的量为0.009 mol |
分析 A..盐酸浓、体积一定,甲中合金质量小于乙中合金质量,且甲中生成气体体积小于乙中气体体积,说明甲中盐酸过量、金属完全反应,乙中合金质量小于丙中合金质量,且乙、丙生成气体体积相等,说明乙、丙中盐酸完全反应,生成672mL氢气需要金属的质量为510mg×$\frac{672mL}{560mL}$=612mg<770mg,故乙中金属剩余,盐酸不足;
B.盐酸完全反应生成氢气672mL,根据n=$\frac{V}{{V}_{m}}$计算氢气的物质的量,根据氢元素守恒可知n(HCl)=2n(H2),进而计算盐酸的浓度;
C.甲中盐酸有剩余,金属完全反应,可以根据甲组数据计算金属的物质的量之比,令镁、铝的物质的量分别为xmol、ymol,根据二者质量之和与电子转移守恒列方程计算解答;
D.根据C中计算可知Mg、Al物质的量之比,再根据n=$\frac{m}{M}$计算Al的物质的量.
解答 解:A.盐酸浓、体积一定,甲中合金质量小于乙中合金质量,且甲中生成气体体积小于乙中气体体积,说明甲中盐酸过量、金属完全反应,乙中合金质量小于丙中合金质量,且乙、丙生成气体体积相等,说明乙、丙中盐酸完全反应,生成672mL氢气需要金属的质量为510mg×$\frac{672mL}{560mL}$=612mg<770mg,故乙中金属剩余,盐酸不足,故A错误;
B.盐酸完全反应生成氢气672mL,可以用乙或丙中的数据计算盐酸的浓度,氢气的物质的量为$\frac{0.672L}{22.4L/mol}$=0.03mol,根据氢元素守恒可知n(HCl)=2n(H2)=2×0.03mol=0.06mol,故盐酸的物质的量浓度为$\frac{0.06mol}{0.06L}$=1mol/L,故B错误;
C.甲中盐酸有剩余,金属完全反应,此时生成氢气560mL,故可以根据甲组数据计算金属的物质的量之比,令镁、铝的物质的量分别为xmol、ymol,根据二者质量可知24x+27y=0.51,根据电子转移守恒有2x+3y=$\frac{0.56L}{22.4L/mol}$×2,联立方程解得:x=0.01、y=0.01,故合金中镁与铝的物质的量之比为0.01mol:0.01mol=1:1,故C正确;
D.合金中镁与铝的物质的量之比为1:1,可知丙中Al的物质的量为$\frac{0.918g}{24g/mol+27g/mol}$=0.018mol,故D错误,
故选:C.
点评 本题考查混合物的计算,关键是根据表中数据关系判断反应的过量问题,侧重考查分析推理与计算浓度,难度中等.


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 3:4 | D. | 1:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.
.原子序数比Y多2的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径比钙小 | |
| B. | 最高价氧化物为SeO3 | |
| C. | H2Se一定是强酸 | |
| D. | 气态氢化物为H2Se,稳定性比H2S 弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 加水稀释至溶液体积为200 mL,醋酸溶液的pH变为4 | |
| B. | 温度都升高20℃后,两溶液的pH不再相等 | |
| C. | 加水稀释至溶液体积为200 mL后,两种溶液中c(OH-)都减小 | |
| D. | 加足量的锌充分反应后,两溶液中产生的氢气体积可用右图表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

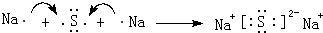 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化合物 | 甲 | 乙 | 丙 | 丁 |
| 化合物中各元素原子个数比 | A和C 1:1 | B和A 1:X | D和E 1:3 | B和E 1:4 |
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com