
【题目】Ⅰ.由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是_______________,装置乙中正极的电极反应式是___________。
(2)四种金属活泼性由强到弱的顺序是_____________________________________。
Ⅱ.美国阿波罗宇宙飞船上使用了一种新型发电装置—氢氧燃料电池,其构造如图所示,其中a、b两个电极均由多孔的碳炔组成,该电池的负极反应式为_________________,若该电池工作时溶液中增加1molH2O,则理论上电路中通过电子的物质的量为________mol。
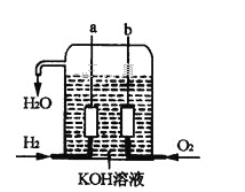
【答案】 A﹣2e- = A2+ Cu2+ +2e- = Cu D>A>B>C H2﹣2e- +2OH-= 2H2O 2
【解析】Ⅰ.(1)该装置中,二价金属A不断溶解,说明A失电子发生氧化反应生成金属阳离子进入溶液而作负极,所以负极电极反应式为A-2e-═A2+,乙装置中,C的质量增加说明C电极上铜离子得电子发生还原反应,则C作正极,电极反应式为Cu2++2e-=Cu,故答案为:A-2e-═A2+;Cu2++2e-=Cu;
(2)通过以上分析知,四种金属活动性强弱顺序是D>A>B>C,故答案为:D>A>B>C;
Ⅱ.氢气、氧气和氢氧化钾溶液构成了原电池,自发的氧化还原反应是氢气和氧气之间的反应,总反应方程式为:2H2+O2=2H2O,负极上通的是氢气,电解液为碱,故电极反应:H2+2OH--2e-═2H2O;若该电池工作时增加了1molH2O,电路中转移电子的物质的量是2mol,故答案为:H2+2OH--2e-═2H2O;2。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】25℃时,在25 mL0.1mol/L的NaOH溶液中,逐滴加入0.2 mol/L的CH3COOH溶液,溶液的pH与CH3COOH 溶液体积关系如图所示。下列有关粒子浓度关系正确的是

A. 曲线上A、B间的任意一点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. B点:c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C. C点:c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D. D点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物的结构(键线式)及球棍模型如图1:该有机分子的核磁共振氢谱图如图2(单位是ppm):下列关于该有机物的叙述正确的是( ) 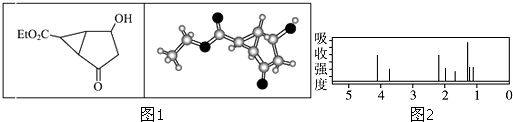
A.该有机物不同化学环境的氢原子有6种
B.该有机物属于芳香化合物
C.键线式中的Et代表的基团为﹣CH3
D.该有机物在一定条件下能够发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚的连线上),戊、己分别是空气、地壳中含量最多的元素。下列判断正确的是

A. 甲一定是金属元素
B. 气态氢化物的稳定性:庚>己>戊
C. 乙、丙、丁的最高价氧化物水化物可以以相互反应
D. 庚的最高价氧化物水化物酸性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚丁二酸乙二醇酯(PES)是一种生物可降解的聚酯,它在塑料薄膜、食品包装和生物材料方面有着广泛的应用.其结构简式为: 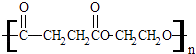 ①聚丁二酸乙二醇酯(PES)是由两种单体通过反应(填反应类型)制得的.形成该聚合物的两种单体是和 .
①聚丁二酸乙二醇酯(PES)是由两种单体通过反应(填反应类型)制得的.形成该聚合物的两种单体是和 .
②这两种单体相互之间也可能形成一种八元环状酯,请写出该环状化合物的结构简式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯、氮、硫的化合物与人类生活和生产有着密切的联系。请回答下列问题:
(1)瑞典化学家舍勒将软锰矿(主要成分是MnO2)与浓盐酸混合加热,在世界上首先制得了氯气。反应的化学方程式为:_________________________。其中,氧化剂是_______。若实验室制得标准状况下4.48L氯气,则转移电子的数目为_____个。
(2)在氮的化合物中,红棕色、有刺激性气味的有毒气体是___________(填写化学式),请写出该气体与水反应的化学方程式________________________。
(3)请配平浓硫酸在加热时与碳发生反应的化学方程式:____C+____H2SO4(浓)=__CO2↑+_____SO2↑+____H2O。
在该反应中,浓H2SO4表现出___________(填“吸水”、“脱水”或“氧化”)性。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是人类从海水资源获取某些重要化工原料的流程示意图:
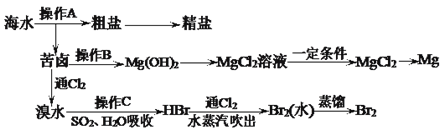
回答下列问题:
(1)操作A是___________和过滤(填实验基本操作名称)。
(2)操作B需加入下列试剂中的一种,最合适的是______(选填编号)。
a.氢氧化钠溶液 b.澄清石灰水 c.石灰乳 d.碳酸钠溶液
(3)工业上由无水MgCl2制取镁的化学方程式为__________________________________。
(4)0.25 mol Cl2缓慢通入含有0.1 mol FeBr2、0.1 mol FeI2的混合溶液中,充分反应,试用一个离子方程式表示总反应:__________________________________________。
(5)某稀硫酸和稀硝酸的混合溶液100 mL,将其平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g铜粉;向另一份中逐渐加入铁粉,产生气体的量随铁粉质量的变化关系如图所示(假设硝酸的还原产物为NO气体)。则原混合溶液中NO3-的物质的量为__________,硫酸的物质的量浓度为______________。
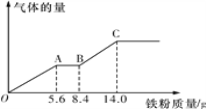
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质和该性质的应用均正确的是
A. 常温下浓硫酸能使铝发生钝化,可在常温下用铝制容器盛装浓硫酸
B. SiO2不与任何酸反应,可用石英制造耐酸容器
C. ClO2具有还原性,可用于自来水的杀菌消毒
D. Al、Fe、Cu对应的氧化物均为碱性氧化物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com