
A.2∶1 B.1∶1 C.1∶2 D.1∶3
科目:高中化学 来源: 题型:
5I-+![]() +6H+====3I2+3H2O
+6H+====3I2+3H2O
2Cu2++4I-====2CuI+I2
反应后,用0.22 mol·L-1 Na2S2O3溶液滴定(I2+2![]() ====2I-+
====2I-+![]() ),消耗了35.30 mL Na2S2O3溶液。计算原饱和溶液中Cu(IO3)2的物质的量浓度以及质量分数分别是多少。
),消耗了35.30 mL Na2S2O3溶液。计算原饱和溶液中Cu(IO3)2的物质的量浓度以及质量分数分别是多少。
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)向200 mL ,某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7。
(1)此时溶液的溶质如果是单一成分,可能是____________________;如果是多种成分,可能是__________________________。
(2)在上述所得溶液中,逐滴缓慢滴加2 mol·L-1的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示:
①加入盐酸200 mL之前,无气体产生,写出OA段发生反应的离子方程式___________________________________________________________________。
②B点时,反应所得溶液中溶质的物质的量浓度是__________ (溶液体积的变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源:2012届山东省鄄城一中高三上学期期中考试化学试卷 题型:填空题
(10分)向200 mL ,某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7。
(1)此时溶液的溶质如果是单一成分,可能是____________________ ;如果是多种成分,可能是__________________________。
;如果是多种成分,可能是__________________________。
(2)在上述所得溶液中,逐滴缓慢滴加2 mol·L-1的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示: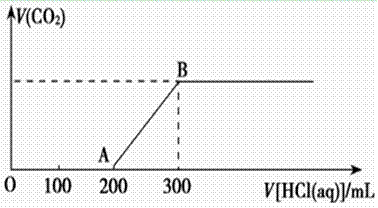
①加入盐酸200 mL之前,无气体产生,写出OA段发生反应的离子方程式_______________ ____________________________________________________。
____________________________________________________。
②B点时,反应所得溶液中溶质的物质的量浓度是__________ (溶液体积的变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年辽宁省高三第五次模拟化学试卷(解析版) 题型:填空题
(1)水是生活中不可缺少的物质,A是短周期有色气态单质,B是短周期元素组成的固态有色化合物,A与B都可与水发生氧化还原反应,反应中水既不作氧化剂也不作还原剂。请写出A、B分别与水反应的化学方程式:_________________,______________
(2)NaAlO2的水溶液呈碱性,其呈碱性的原因是(用必要的文字和离子方程式表示)_____________
(3)NaNH2可由金属钠与液氨反应得到,遇水产生两种碱。写出NaNH2与水反应的化学方程式__________
(4) 已知常温下AgCl与AgI的溶度积分别是1.0×10-10和1.5×10-16。若向200 mL饱和AgCl溶液中加入等体积的KI溶液,为使饱和溶液中产生AgI沉淀,则所需加入的KI溶液的物质的量浓度最小是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com