
| A.-386 kJ/mol | B.+386 kJ/mol | C.-746 kJ/mol | D.+746 kJ/mol |
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2.44 kJ | B.4.88 kJ | C.44.0 kJ | D.88.0 kJ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH3OH的燃烧热为192.9 kJ·mol-1 |
| B.CH3OH的燃烧热为133.9 kJ·mol-1 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
| D.根据②推知反应:CH3OH(l) +1/2O2(g) = CO2(g) +2H2(g)的DH >-192.9 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
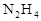 作燃料,
作燃料,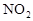 作氧化剂,两者反应生成N2和水蒸气,已知:
作氧化剂,两者反应生成N2和水蒸气,已知: △H1=+67.7kJ/mol
△H1=+67.7kJ/mol查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
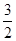 O2(g)=== Al2O3(s) △H=" -1" 644.3 kJ? mol-1
O2(g)=== Al2O3(s) △H=" -1" 644.3 kJ? mol-1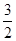 O2(g)=== Fe2O3(s) △H=" -815.88" kJ? mol-1
O2(g)=== Fe2O3(s) △H=" -815.88" kJ? mol-1查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)△H=" -1367.0" kJ/mol(燃烧热) |
| B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H= +57.3kJ/mol(中和热) |
| C.S(s)+O2(g)=SO2(g)△H= -269.8kJ/mol(反应热) |
| D.2NO2=O2+2NO△H=+116.2kJ/mol(反应热) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com