
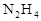 作燃料,
作燃料,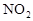 作氧化剂,两者反应生成N2和水蒸气,已知:
作氧化剂,两者反应生成N2和水蒸气,已知: △H1=+67.7kJ/mol
△H1=+67.7kJ/mol 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源:不详 题型:单选题
| A.吸收29.2 kJ热量 | B.放出29.2 kJ热量 |
| C.放出7.3 kJ热量 | D.吸收7.3 kJ热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.CH3OH(l) + 3/2O2(g) = CO2(g) + 2H2O(l);△H=+725.8 kJ·mol—1 |
| B.2CH3OH(l) +3O2(g) = 2CO2(g) + 4H2O(l);△H=-725.8 kJ·mol—1 |
| C.CH3OH(l) + 3/2O2(g) = CO2(g) + 2H2O(l);△H=-725.8 kJ·mol—1 |
| D.2CH3OH(l) + 3O2(g) = 2 CO2(g) + 4H2O(g);△H=-1451.6 kJ·mol—1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.由反应①可推知:CH4(g)+4NO2(g)= 4NO(g)+CO2 ( g ) +2H2O ( l) ;DH>-574 kJ/mol |
| B.反应①②转移的电子数相同 |
| C.若用标准状况下 4.48LCH4还原 NO2至 N2,设水为气态,则放出的热量为 1734kJ。 |
| D.若用标准状况下 4.48LCH4还原 NO2至 N2,则整个过程中转移的电子总数为1.60 mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-386 kJ/mol | B.+386 kJ/mol | C.-746 kJ/mol | D.+746 kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2 H2(g) + O2(g) =" 2" H2O(l);△H =-142.9kJ/mol |
| B.2 H2(g) + O2(g) =" 2" H2O(g);△H =-571.6kJ/mol |
| C.2 H2 + O2 =" 2" H2O;△H =-571.6kJ/mol |
D.H2(g) +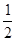 O2(g) = H2O(l);△H =-285.8kJ/mol O2(g) = H2O(l);△H =-285.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
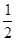 CH4(g)+O2(g)=
CH4(g)+O2(g)= 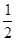 C02(g)+H2O(1);?H =-445.15kJ·mol-1
C02(g)+H2O(1);?H =-445.15kJ·mol-1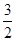 O2(g)=CO(g)+2H2O(1); ?H=-607.3kJ·mol-1
O2(g)=CO(g)+2H2O(1); ?H=-607.3kJ·mol-1| A.445.15 kJ·mol-1 | B.607.3 kJ·mol-1 | C.890.3 kJ·mol-1 | D.802.3 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
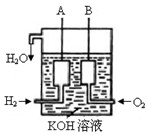
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com