
| A.烧杯 | B.坩埚 | C.表面皿 | D.泥三角 E.酒精灯 F.干燥器 |
 互动英语系列答案
互动英语系列答案科目:高中化学 来源:不详 题型:单选题
| A.NaCl(Na2CO3)——加稀盐酸,分液 |
| B.SO2(HCl)——氢氧化钠溶液,洗气 |
| C.NaCl溶液(碘)——四氯化碳,萃取、分液 |
| D.KNO3溶液(KCl)——降温结晶,蒸馏 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 7.6 |
| 完全沉淀pH | 4.1 | 5.2 | 9.6 |
| 温度(℃) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.BaCl2溶液、Ba(NO3)2溶液、Na2CO3溶液 |
| B.NaCl溶液、Ba(NO3)2溶液、Na2CO3溶液 |
| C.KCl溶液、 Ba(NO3)2溶液、MgCl2溶液 |
| D.NaCl溶液、K2CO3溶液、Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.溴水和碘水(淀粉溶液) |
| B.硫酸铵与氯化铵(采用加碱加热闻其气味的方法) |
| C.NaCl与KCl(采用灼烧观察焰色的方法) |
| D.K2CO3与KNO3(采用加盐酸观察其是否有气泡产生的方法) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| 金属离子 | Fe3+ | Fe2+ | Cu2+ | |
| pH | 氢氧化物开始沉淀 | 1.9 | 7.0 | 4.7 |
| 氢氧化物安全沉淀 | 3.2 | 9.0 | 6.7 | |
查看答案和解析>>
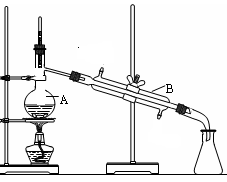
科目:高中化学 来源:不详 题型:实验题

 中填写所使用除杂试剂的化学式__________,在( )中的操作名称是____ ___。
中填写所使用除杂试剂的化学式__________,在( )中的操作名称是____ ___。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入AgNO3溶液,生成白色沉淀,加稀盐酸沉淀不溶解,可确定有Cl—存在 |
| B.加入几滴Fe2(SO4)3溶液,溶液变成紫色,可确定有酚羟基存在 |
| C.加入Ba(NO3)2溶液,生成白色沉淀,加稀盐酸沉淀不消失,可确定有SO42-存在 |
| D.加入盐酸,生成的气体能使澄清石灰水变浑浊,可确定有CO32-存在 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验目的 | 第一方案 | 第二方案 |
| A | 除去氯化钙固体中少量氯化铵 | 与熟石灰混合加热 | 直接加热 |
| B | 清洗热水瓶中的水垢 | 用食醋洗涤 | 用洗洁精洗涤 |
| C | 检验亚硫酸钠是否被氧化 | 滴入Ba(OH)2溶液 | 滴入盐酸酸化的BaCl2溶液 |
| D | 区分黄铜(铜锌合金)和黄金 | 测量密度 | 加盐酸,看气泡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com