
| | 实验目的 | 第一方案 | 第二方案 |
| A | 除去氯化钙固体中少量氯化铵 | 与熟石灰混合加热 | 直接加热 |
| B | 清洗热水瓶中的水垢 | 用食醋洗涤 | 用洗洁精洗涤 |
| C | 检验亚硫酸钠是否被氧化 | 滴入Ba(OH)2溶液 | 滴入盐酸酸化的BaCl2溶液 |
| D | 区分黄铜(铜锌合金)和黄金 | 测量密度 | 加盐酸,看气泡 |
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源:不详 题型:实验题
| A.烧杯 | B.坩埚 | C.表面皿 | D.泥三角 E.酒精灯 F.干燥器 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 物质 | 所用试剂 | 方法 |
| A. | 乙醇(乙酸) | 氢氧化钠溶液 | 分液 |
| B. | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C. | 乙酸乙酯(乙酸) | 饱和碳酸钠溶液 | 蒸馏 |
| D. | 乙醇(水) | 生石灰 | 蒸馏 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加入氨水,产生白色沉淀,证明原溶液中存在Al3+ |
| B.加入AgNO3溶液,产生白色沉淀,证明原溶液中存在Cl- |
| C.加入盐酸酸化的BaCl2溶液,生成白色沉淀,证明原溶液中存在SO42- |
| D.加入NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体,证明原溶液中存在NH4+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①④②③ | B.①③②④ | C.④②①③ | D.④③②① |
查看答案和解析>>
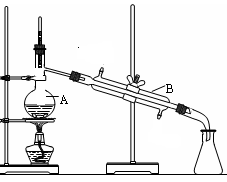
科目:高中化学 来源:不详 题型:实验题
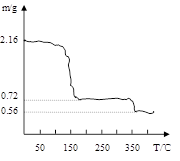
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
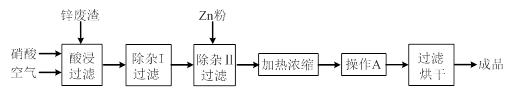
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
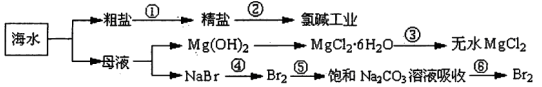
| A.第①步中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 |
| B.第②步中工业上可采用石墨为阴极,铁为阳极,采用阳离子交换膜的电解装置 |
| C.第③步中结晶出的MgCl2·6H2O可在空气中受热分解制无水MgCl2 |
| D.在第④步中溴元素被氧化,第⑤、⑥步中既有溴元素被氧化也有溴元素被还原 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.A1C13可能存在 | B.澄清溶液呈无色 |
| C.Ag (NH3)2+会在酸中离解 | D.澄清溶液中c (OH-)>c (Cl-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com