
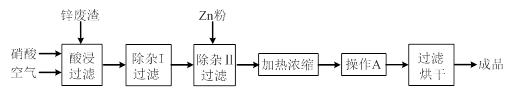
| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 4.2 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 6.7 | 8.0 |


科目:高中化学 来源:不详 题型:实验题
| 试验序号 | 实 验 步 骤 | 实 验 现 象 | 结 论 |
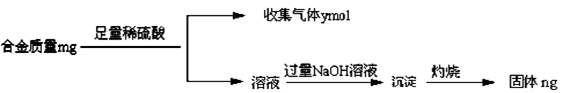
| ① | 取少量该焰火原料加入冷水 | 无明显现象 | ________________ |
| ② | 取少量该焰火原料加入稀盐酸 | 完全溶解,有大量气体 | _________________ |

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

 中填写所使用除杂试剂的化学式__________,在( )中的操作名称是____ ___。
中填写所使用除杂试剂的化学式__________,在( )中的操作名称是____ ___。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题



 【材料二】我国实际工业利用海带制取碘,采用的是离子交换法,其流程如下:
【材料二】我国实际工业利用海带制取碘,采用的是离子交换法,其流程如下:
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| | 实验目的 | 第一方案 | 第二方案 |
| A | 除去氯化钙固体中少量氯化铵 | 与熟石灰混合加热 | 直接加热 |
| B | 清洗热水瓶中的水垢 | 用食醋洗涤 | 用洗洁精洗涤 |
| C | 检验亚硫酸钠是否被氧化 | 滴入Ba(OH)2溶液 | 滴入盐酸酸化的BaCl2溶液 |
| D | 区分黄铜(铜锌合金)和黄金 | 测量密度 | 加盐酸,看气泡 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 Al(OH)3+OH-。
Al(OH)3+OH-。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| | Si | Fe | Cu | Mn | Mg | Cr | Zn | Ti | Al |
| 罐身/% | 0.3 | 0.7 | 0.25 | 0.25 | 1.0~1.5 | | | | 其余 |
| 罐盖/% | 0.2 | 0.35 | 0.15 | 0.2~0.5 | 4.0~5.0 | | 0.1 | 0.25 | 其余 |
| 拉环/% | 0.2 | 0.35 | 0.15 | 0.2~0.5 | 3.0~4.0 | 0.1 | 0.25 | 0.1 | 其余 |
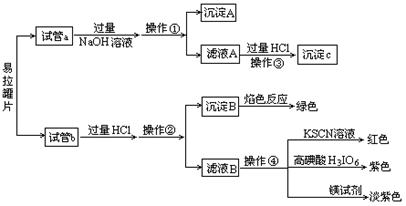
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层) 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
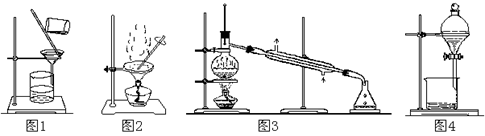
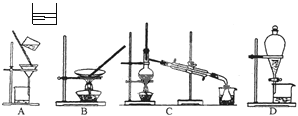
| A.用图1 所示装置从Fe(OH)3胶体中过滤出Fe(OH)3胶粒 |
| B.用图2 所示装置蒸发掉CuCl2溶液中部分水制得CuCl2·2H2O晶体 |
| C.用图3 所示装置从CH3OH与C2H5OH的混合物中分离出乙醇 |
| D.用图4 所示装置从C2H5OH与C2H5OOCCH3的混合物中分离出乙酸乙酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com