
【题目】一定量的某有机物完全燃烧后,将燃烧产物通过足量的石灰水,经过滤可得沉淀10g,但称量滤液时,其质量只比原石灰水减少2.9g,则此有机物可能是:
A. C2H4 B. C2H4O2
C. C2H6O D. C4H10O
【答案】C
【解析】
有机物燃烧产物有二氧化碳和水,将燃烧产物通过足量的石灰水,经过滤可得沉淀10g,沉淀应为CaCO3,根据方程式:CO2+Ca(OH)2===CaCO3↓+H2O,可计算发生反应导致滤液减少的质量,称量滤液时,其质量只比原石灰水减少2.9g,根据质量守恒再计算有机物燃烧生成水的质量,以此解答该题。
有机物燃烧产物有二氧化碳和水,将燃烧产物通过足量的石灰水,经过滤可得沉淀10g,沉淀应为CaCO3,根据碳原子守恒可知n(CO2)=n(CaCO3)=![]() =0.1mol,故该有机物中碳原子为0.1mol;
=0.1mol,故该有机物中碳原子为0.1mol;
根据方程式:CO2+Ca(OH)2===CaCO3↓+H2O 滤液减少的质量△m
74g 100g 18g 56g
10g 5.6g
称量滤液时,其质量只比原石灰水减少2.9g,则有机物燃烧生成水的质量应为5.6g2.9g=2.7g,则n(H)=2n(H2O)=![]() =0.3mol,则有机物中N(C):N(H)=1:3,只有C项符合,故答案为C。
=0.3mol,则有机物中N(C):N(H)=1:3,只有C项符合,故答案为C。


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】如图是实验室制备SO2并验证SO2某些性质的装置图。试回答:

(1)写出仪器A的名称___,写出此实验中制备SO2化学方程式___。
(2)C中的现象是___,此实验证明SO2是___气体。
(3)D中的反应现象证明SO2有___性;F中的现象是___,G中SO2与碘水反应的方程式:___。
(4)H中的试剂是氢氧化钠溶液,用于吸收多余的二氧化硫气体,防止污染空气;反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图。下列有关叙述正确的是( )
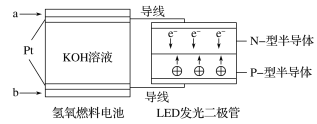
A.a处通入氧气,b处通入氢气
B.通入H2的电极发生反应:H2-2e-=2H+
C.通入O2的电极为电池的正极
D.该装置将化学能最终转化为电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.20℃时,饱和KCl溶液的密度为1.174 g·cm-3,质量分数为![]() ×100%,此溶液中KCl的物质的量浓度为4.0 mol·L-1
×100%,此溶液中KCl的物质的量浓度为4.0 mol·L-1
B.100g浓度为c mol·L-1的氨水中加入一定量的水稀释成0.5cmol·L-1,则加入水的体积大于100ml(已知氨水的浓度越大,其密度越小)
C.将标准状况下的aLHCl气体溶于1000mL水中,得到的盐酸溶液密度为bg/mL,则该盐酸溶液的物质的量浓度为![]() mol/L
mol/L
D.V L Fe2(SO4)3溶液中含Fe3+m g,则溶液中SO42—的物质的量浓度为![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式为 ,下列叙述不正确的是( )
,下列叙述不正确的是( )
A. 1mol该有机物在加热和催化剂作用下,最多能和4molH2反应
B. 该有机物能使溴水褪色,也能使酸性KMnO4溶液褪色
C. 该有机物的分子式为C11H15Cl
D. 该有机物在一定条件下能发生消去反应或取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入AgNO3溶液后溶液颜色变浅
HBr+HBrO,当加入AgNO3溶液后溶液颜色变浅
B. 对2HI(g)![]() H2(g)+I2(g),增大压强可使平衡体系颜色变深
H2(g)+I2(g),增大压强可使平衡体系颜色变深
C. 反应CO+NO2![]() CO2+NO ΔH<0,升高温度可使平衡向逆反应方向移动
CO2+NO ΔH<0,升高温度可使平衡向逆反应方向移动
D. 合成NH3反应,为提高NH3的产率,理论上应采取低温度的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.01mol/LNaAc溶液的pH,溶液中HAc、Ac-、H+、OH-浓度的对数值lgc与溶液pH的变化关系如图所示。若pKa=-lgKa,下列叙述错误的是

A. 直线b、d分别对应H+、OH-
B. pH=6时,c(HAc)>c(Ac-)>c(H+)
C. HAc电离常数的数量级为10-5
D. 从曲线a与c的交点可知pKa=pH=4.74
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸镍是一种重要的化工中间体,是镍行业研究的热点。一种以石油化工中废镍催化剂(主要成分为NiCO3和SiO2,含少量Fe2O3、Cr2O3)为原料制备硫酸镍的工业流程如下:
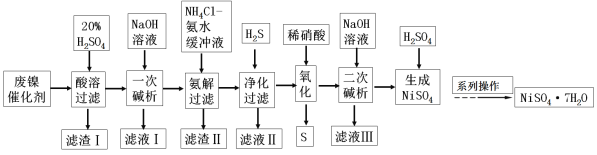
已知:① NiS、Ni(OH)2、Cr(OH)3均难溶于水,Cr(OH)3是两性氢氧化物。
②Fe(OH)3不溶于NH4Cl—氨水的混合液,Ni(OH)2溶于NH4Cl—氨水的混合液生成[Ni(NH3)6]2+。
③离子浓度≤10-5mol·L-1时,离子沉淀完全。
请回答下列问题:
(1)“酸溶”时应先将废镍催化剂粉碎,再与20%硫酸在100℃下反应2小时,该操作的目的为_____。
(2)“滤渣I”主要成分在工业上的用途为___(只写1种即可),NH4Cl的电子式为_____。
(3)“一次碱析”时,加入的NaOH溶液需过量,则含铬微粒发生反应的离子方程式为____。
(4)“氨解”的目的为________, “净化”时加入的H2S的目的是将镍元素转化为NiS沉淀,对应的离子方程式为:________。
(5)“氧化”时发生反应的离子方程为________。
(6)“二次碱浸”时,若使溶液中的Ni2+沉淀完全,则需维持c(OH-)不低于____。(已知Ni(OH)2的Ksp=2×10-15,![]() ≈1.4)。
≈1.4)。
(7)工业上利用电解法处理含氯化镍的酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是________。
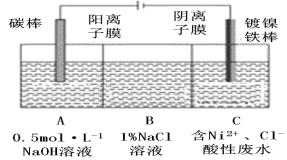
已知:①Ni2+在弱酸性溶液中发生水解;
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)。
A.碳棒上发生的电极反应:4OH--4e-=O2↑+2H2O
B.电解过程中,B中NaCl溶液的物质的量浓度将不断减小
C.为了提高Ni的产率,电解过程中需要控制废水pH
D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com