
下列说法正确的是
A.金属腐蚀就是金属原子失去电子被还原的过程
B.合金都比纯金属易被腐蚀
C.将金属与外加直流电源的负极相连,而将正极接到废铁上,可以防止金属被腐蚀
D.钢铁设备上连接铜块可以防止钢铁被腐蚀
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
可逆反应a A(s)+b B(g)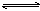 c C(g)+d D(g),反应过程中,当其它条件不变时,C的百分
c C(g)+d D(g),反应过程中,当其它条件不变时,C的百分 含量(C%)与温度(T)和压强(P)的关系如下图下列叙述正确的是
含量(C%)与温度(T)和压强(P)的关系如下图下列叙述正确的是
A、达平衡后,加入催化剂则C%增大
B、达平衡后,若升温,平衡左移
C、化学方程式中b >c +d
D、达平衡后,增加A的量有利于平衡向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
质量分数为n的NaOH溶液,其物质的量浓度为amol/L,加热蒸发水使其质量分数变为2n,此时,该溶液中的物质的量浓度为bmol/L,则a与b的关系正确的是( )
|
| A. | b>2a | B. | b<2a | C. | b=2a | D. | a=2b |
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组为了了解HCl、NaHSO4、NaHCO3在水溶液中的电离情况,进行了下列实验;
①分别测定了0.1mol/L的HCl、NaHSO4、NaHCO3溶液中H+的物质的量浓度,HCl溶液中c(H+)=0.1mol/L,NaHSO4溶液中c(H+)=0.1mol/L,而NaHCO3溶液中H+的物质的量浓度远远小于0.1mol/L.
②取少量NaHSO4溶液于试管中,滴入BaCl2溶液有不溶于硝酸的白色沉淀生成.
③取少量NaHCO3溶液于试管中,滴入几滴BaCl2无明显现象.
(1)请根据该小组同学的实验结果,分别写出NaHSO4、NaHCO3在水溶液中的电离方程式:
①NaHSO4: NaHSO4=Na++H++SO42﹣ 、
②NaHCO3: NaHCO3═Na++HCO3﹣ 、
(2)写出②中反应的离子方程式: SO42﹣+Ba2+=BaSO4↓ .
查看答案和解析>>
科目:高中化学 来源: 题型:
白磷在高压下隔绝空气加热后急速冷却,可得钢灰色固体黑磷,其转化过程中能量变化如图所示。下列叙述中正确的是
A.黑磷比白磷稳定 B.黑磷与白磷互为同分异构体
C.白磷转化为黑磷是氧化还原反应
D.白磷转化为黑磷是吸热反应
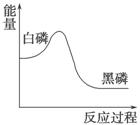
查看答案和解析>>
科目:高中化学 来源: 题型:
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l) Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是
A 电池工作时,锌失去电子
B 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq)
C 电池工作时,电子由正极通过外电路流向负极
D 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知2 mol氢气燃烧生成液态水时放出572 kJ热量,反应方程式是2H2(g)+O2(g)===2H2O(l) 请回答下列问题:
①该反应的生成物能量总和________(填“大于”、“小于”或“等于”)反应物能量总和。
②若2 mol氢气完全燃烧生成水蒸气,则放出的热量________(填“>”、“<”或“=”)572 kJ。
(2)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)  2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l) ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应的热化学方程式是_________ _______。
(3)已知下列反应的热化学方程式:
①6C (s)+5H2(g)+3N2(g)+9O2(g)===2C3H5(ONO2)3(l) ΔH1
②2H2(g)+O2(g)===2H2O(g) ΔH2
③C(s)+O2(g)===CO2(g) ΔH3
则反应4C3H5(ONO2)3(l)===12CO2(g)+10H2O(g)+O2(g)+6N2(g)的ΔH为____ ____。
查看答案和解析>>
科目:高中化学 来源: 题型:
芳香烃X是一种重要的化工原料,其相对分子质量为92,现以它为初始原料设计出如下转化关系图(部分产物、合成路线、反应条件略去)。其中A是一氯代物,F的分子式为C7H7NO2,Y是一种功能高分子材料。
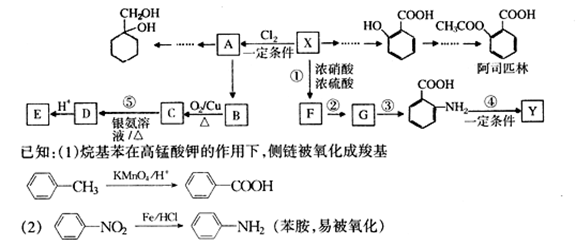
请根据本题所给信息与所学知识回答下列问题:
(1) X→A “一定条件”是指的何种条件__ ___ ,反应③的条件
(2)写出反应类型:反应① ,反应② 。
(3)阿司匹林与足量NaOH溶液反应的化学方程式 。
(4)Y的结构简式为 。
(5)以下是由A和其他物质合成 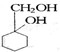 的流程图:
的流程图:
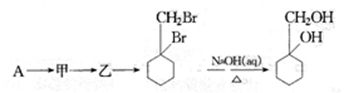
完成甲→乙的化学反应方程式: 。
(6)
比  多一个碳原子的同系物M有多种同分异构体, 同时符合下列4个条件的M同分异构体有 种
多一个碳原子的同系物M有多种同分异构体, 同时符合下列4个条件的M同分异构体有 种
①分子中含有苯环;
②能发生水解反应;
③在苯环上只能生成2种一氯取代物.
④常温下不与NaHCO3反应
查看答案和解析>>
科目:高中化学 来源: 题型:
KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯,其变化可表述为: 2KClO3 + 4HCl(浓) = 2 KCl + 2 ClO2↑ + Cl2↑ + 2 H2O
(1) 用“双线桥法”标出电子转移的方向和数目。
(2) 浓盐酸在反应中显示出来的性质是___________(填编号)
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(3) 产生0.1 mol Cl2,则转移的电子的数目为______,标况下该反应产生气体体积为
(4) 还原剂和还原产物物质的量之比
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com