解答:解:W、Y、Z、Q、R是周期表中前四周期的元素,且原子序数依次增大.Q是电负性最大的元素,则Q为F元素;W原子核外有2个未成对电子,原子序数小于F且相差至少为3,处于第二周期,W核外电子排布为1s
22s
22p
2,则W为C元素;结合原子序数可知,Y为N元素、Z为O元素;R元素的原子核外的未成对电子数是W原子核外未成对电子数的2倍,则R原子未成对电子数为4,则R处于第四周期,其原子核外电子排布为1s
22s
22p
63s
23p
63d
64s
2,则R为Fe元素,
(l)同周期自左而右元素第一电离能呈增大趋势,但N元素的2p能级容纳3个电子,处于半满稳定状态,能量较低,第一电离能高于同周期相邻元素,故第一电离能N>O>C;在上述三种元素的原子中,写出与CO
2互为等电子体的分子式N
2O,
故答案为:N>O>C;N
2O;
(2)F原子成一个共价键,由模型可知:白色球表示F、黑色球表示N,N原子之间应成N=N双键,N
2F
2分子中N原子价层电子对数=2+
=3,N原子采取sp
2杂化,
故答案为:sp
2;
(3)C
22-阴离子中C原子之间形成三对共用电子对,且都满足8电子稳定结构,其电子式为
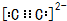
,O原子最外层电子排布式为2s
22p
4,
故答案为:
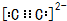
;2s
22p
4;
(4)NF
3分子中N原子价层电子对数=3+
=4,N原子含有1对孤对电子,故其空间构型为三角锥形;
Y和Q两元素的氢化物分别为NH
3、HF,由于电负性F>N,故HF分子之间的氢键比NH
3分子之间的氢键更强,且HF的范德华力更强,故HF的沸点更高;
由于电负性F>N>H,NF
3分子中共用电子对偏向F原子,使得N原子上的孤对电子难与Cu
2+形成配合物,
故答案为:三角锥形;HF;由于电负性F>N>H,NF
3分子中共用电子对偏向F原子,使得N原子上的孤对电子难与Cu
2+形成配合物;
(5)科学家通过X射线探明FeO的晶体结构与NaCl晶体结构相似.若以为Fe
2+体心,在FeO晶体中距离Fe
2+最近且等距离的Fe
2+位于棱的中心上,故共有12个;FeO的晶体结构与NaCl的晶体结构相似,则一个晶胞中含有4个“FeO”,N
A个“FeO”的质量为72g,FeO晶体中阴阳离子间最近距离为acm,则体积为(2a cm)
3=8a
3 cm
3,晶胞质量为8a
3 cm
3×ρg/cm
3=8ρa
3g,所以
×4=8ρa
3g,故N
A=
,
故答案为:12;
;
(6)设1molFe
0.95O中含有Fe
3+有x mol,Fe
2+有y mol,利用电荷守恒和原子守恒,则有
,
解之得:x=0.1,y=0.85,故Fe
0.95O可表示为Fe
2+0.85Fe
3+0.1O,
故答案为:D.

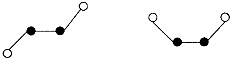
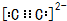 ,O原子最外层电子排布式为2s22p4,
,O原子最外层电子排布式为2s22p4,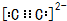 ;2s22p4;
;2s22p4;

 名校课堂系列答案
名校课堂系列答案 【化学--选修3物质结构与性质】
【化学--选修3物质结构与性质】
 该配离子中含有的化学键类型有
该配离子中含有的化学键类型有

