
关于 Na2CO3和NaHCO3下列说法不正确的是
A.可以用加热的方法除去Na2CO3中的NaHCO3
B.分别向Na2CO3和NaHCO3溶液滴加少量盐酸,产生CO2气体较快的为NaHCO3
C.可以用Ca(OH)2溶液区分Na2CO3和NaHCO3溶液
D.Na2CO3比NaHCO3易溶于水
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源:2014-2015学年广东省佛山市高三上学期第一次月考化学试卷(解析版) 题型:实验题
下列实验现象预测正确的是
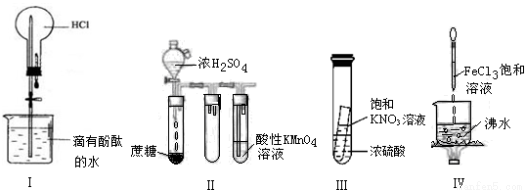
A.实验I:打开止水夹,烧瓶内出现红色喷泉
B.实验II:酸性KMnO4溶液中出现气泡,颜色无明显变化
C.实验III:静置一段时间,小试管内有晶体析出
D.实验IV:烧杯中液体变为红褐色后,继续加热煮沸,会出现浑浊
查看答案和解析>>
科目:高中化学 来源:2016届安徽省等六校教研会高三第一次联考化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式是
A、Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-=2Fe2++I2+3H2O
B、0.1mol/LNH4Al(SO4)2溶液与0.2mol/LBa(OH)2溶液等体积混合:Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+AlO2-+2H2O
C、用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
D、向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2 +H2O = HClO+HSO3-
查看答案和解析>>
科目:高中化学 来源:2016届湖北省高三9月调考化学试卷(解析版) 题型:选择题
常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,平衡时pH随溶液体积变化的曲线如图所示,则下列叙述不正确的是
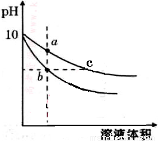
A.b、c两点溶液的导电能力不相同
B.a、b、c三点溶液中水的电离程度a>c>b
C.c点溶液中C(H+) + C(CH3COOH)= C(OH-)
D.用相同浓度的盐酸分别与等体积的b、c处溶液反应,消耗盐酸体积Vb=Vc
查看答案和解析>>
科目:高中化学 来源:2016届广西桂林市高三第一次月考化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数,下列说法正确的是
① 18g D2O含有的电子数为10NA;
② 1mol Na2O2与水完全反应时转移电子数为2NA ;
③ 12g石墨烯(单层石墨)中含有六元环的个数为0.5NA;
④ 在标准状况下,22.4LSO3的物质的量为1mol;
⑤ 7.8g过氧化钠中含有的离子数为0.3NA;
⑥ 28g 硅晶体中含有2NA个Si—Si键
⑦ 200mL1mol/LFe2(SO4)3溶液中,Fe3+和SO42-离子数的总和是NA
⑧ 在常温常压下,0.1mol铁与0.1molCl2充分反应,转移的电子数为0.3NA
⑨ 标准状况下,22.4LNO和11.2LO2混合后气体的分子总数为1.5NA
⑩ S2和S8的混合物共6.4g,其中所含硫原子数一定为0.2NA
A、①③⑤⑧ B、②④⑥⑦ C、③⑤⑥⑩ D、⑤⑧⑨⑩
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省大连市高三期初考试化学试卷(解析版) 题型:选择题
下列有关物质结构的表述正确的是
A.次氯酸的电子式
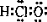 B.乙烯的结构简式:C2H4
B.乙烯的结构简式:C2H4
C.二氧化碳的比例模型: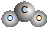 D.Cl-的结构示意图:
D.Cl-的结构示意图:
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期开学考试化学试卷(解析版) 题型:填空题
CaO2难溶于水,溶于酸生成过氧化氢,在医药上用作杀菌剂、防腐剂等。
Ⅰ.CaO2制备原理:Ca(OH)2(s)+H2O2(aq)===CaO2(s)+2H2O(l);ΔH<0
不同浓度的H2O2对反应生成CaO2产率的影响如下表:
H2O2/% | 5 | 10 | 15 | 20 | 25 | 30 |
CaO2/% | 62.40 | 63.10 | 63.20 | 64.54 | 62.42 | 60.40 |
(1)分析题给信息,解释H2O2浓度大于20%后CaO2产率反而减小的原因: 。
Ⅱ.过氧化钙中常含有CaO杂质,实验室可按以下步骤测定CaO2含量。
步骤1:准确称取0.04~0.05 g过氧化钙样品,置于250 mL的锥形瓶中;
步骤2:分别加入30 mL蒸馏水和2 mL盐酸(3 mol·L-1),振荡使之溶解;
步骤3:向锥形瓶中加入5 mL KI溶液(100 g·L-1);
步骤4:用硫代硫酸钠标准溶液滴定,至溶液呈浅黄色,然后________,用硫代硫酸钠标准溶液继续滴定,________,记录数据;
步骤5:平行测定3次,计算试样中CaO2的质量分数。滴定时发生的反应为2Na2S2O3+I2===Na2S4O6+2NaI。
(2)过氧化钙溶解时选用盐酸而不选用硫酸溶液的原因是 。
(3)加入KI溶液后发生反应的离子方程式为 。
(4)请补充完整实验步骤4中的内容:____________;____________。
查看答案和解析>>
科目:高中化学 来源:2016届山东省枣庄市高三9月阶段性学情检测化学试卷(解析版) 题型:填空题
化合物甲和NaAlH4都是重要的还原剂。一定条件下金属钠和H2反应生成甲。甲与水反应可产生H2,甲与AlCl3反应可得到NaAlH4。将4.80g甲加热至完全分解,得到金属钠和2.24 L(已折算成标准状况)的H2。请推测并回答:
(1)甲的化学式__________。
(2)甲与AlCl3反应得到NaAlH4的化学方程式: __________。
(3)NaAlH4与水发生氧化还原反应的化学方程式: __________。
(4)甲在无水条件下可作为某些钢铁制品的脱锈剂(铁锈的成分表示为Fe2O3)脱锈过程发生的化学方程式_________ 。
(5)某同学认为:用惰性气体赶尽反应体系中的空气,将铁和盐酸反应后的气体经浓硫酸干燥,再与金属钠反应,得到的固体物质即为纯净的甲;取该固体物质与水反应,若能产生H2,即可证明得到的甲一定是纯净的。
判断该同学设想的制备和验纯方法的合理性并说明理由___________ 。
查看答案和解析>>
科目:高中化学 来源:2016届重庆市高三7月月考化学试卷(解析版) 题型:填空题
(14分)亚硫酸钠(Na2SO3)、漂白液(NaClO)和明矾[KAl(SO4)2?12H2O]都是重要的化工产品,在日常生活和工业生产中都有广泛用途,且三者都可用在造纸业的不同生产工序中。
(1)NaClO做消毒液是它能与水反应产生一种强氧化性物质,写出该强氧化性物质的电子式_______。在工业上,用氯化钠为原料,在碱性溶液中,通过电解的方法可制得NaClO,用离子方程式表示制取NaClO的电解总反应:____________。将等浓度等体积的NaClO与Na2SO3溶液混合后,两者恰好完全反应,写出混合过程的离子反应方程式 ____________。
(2)将饱和NaClO和KAl(SO4)2溶液混合,置于一只带单孔橡皮塞的大试管中,产生大量的白色胶状沉淀。此时反应的离子方程为____________。再将大试管置于阳光下照射,不久试管液面上方有浅黄绿色气体产生,将气体通入NaOH溶液充分吸收后,还能收集到一种无色无味的气体。写出在阳光照射下,混合液中反应的化学方程式____________。
若将KAl(SO4)2溶液换成硫酸亚铁铵【(NH4)2SO4?FeSO4】溶液后,再与NaClO溶液混合,观察到大试管中有红褐色沉淀产生,同时溶液里现黄色,但没有气体生成。此时试管中发生反应的离子方程式为______。
(3)取一定体积KAl(SO4)2溶液于试管中,逐滴加入一定浓度的Ba(OH)2溶液, 直至产生沉淀的质量最大,写出此时的离子反应方程式____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com