
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子。Y元素原子的最外层2p轨道上有2个未成对电子,X跟Y可形成化合物X2Y3。Z元素可以形成负一价离子。请回答下列问题:
(1)X元素基态原子的电子排布式为_________,该元素的符号是____。
(2)Y元素原子的价层电子排布图为_________,该元素的名称是____。
(3)已知化合物X2Y3在稀硫酸中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是___________。
【答案】1s22s22p63s23p63d104s24p3 As ![]() 氧 As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O
氧 As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O
【解析】
X元素原子的4p轨道上有3个未成对电子,则可以知道X元素原子基态时的电子排布式为1s22s22p63s23p63d104s24p3,为As,Y元素原子的最外层2p轨道上有2个未成对电子,则元素原子基态时的电子排布式为1s22s22p4,为O,X、Y和Z三种元素的原子序数之和等于42,X原子序数为33,Y为8,则Z为H原子,X与Z可形成化合物AsH3,该化合物的空间构型和氨气相似,为三角锥形,据此分析解答问题。
(1)由以上分析可知X为As,电子排布式为1s22s22p63s23p63d104s24p3,故答案为:1s22s22p63s23p63d104s24p3;As;
(2)Y为氧元素,原子的价层电子的轨道表示式为![]() ,故答案为:
,故答案为:![]() ;氧;
;氧;
(3)已知化合物As2O3在稀硫酸溶液中可被金属锌还原为AsH3,产物还有ZnSO4和H2O,则反应方程式为:As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O,故答案为:As2O3+6Zn+6H2SO4═2AsH3↑+6ZnSO4+3H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】硫代硫酸钠在纺织业等领域有广泛应用。某兴趣小组用下图装置制备![]() 。
。
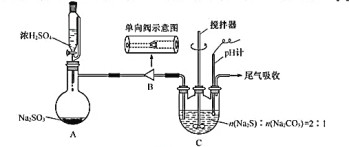
合成反应:![]()
![]()
![]()
滴定反应:![]()
已知:![]() 易溶于水,难溶于乙醇,
易溶于水,难溶于乙醇,![]() 开始失结晶水。
开始失结晶水。
实验步骤:
Ⅰ.![]() 制备:装置A制备的
制备:装置A制备的![]() 经过单向阀通入装置C中的混合溶液,加热、搅拌,至溶液
经过单向阀通入装置C中的混合溶液,加热、搅拌,至溶液![]() 约为7时,停止通入
约为7时,停止通入![]() 气体,得产品混合溶液。
气体,得产品混合溶液。
Ⅱ.产品分离提纯:产品混合溶液经蒸发浓缩、冷却结晶、过滤洗涤、干燥,得到![]() 产品。
产品。
Ⅲ.产品纯度测定:以淀粉作指示剂,用![]() 产品配制的溶液滴定碘标准溶液至滴定终点,计算
产品配制的溶液滴定碘标准溶液至滴定终点,计算![]() 含量。
含量。
请回答:
(1)步骤Ⅰ:单向阀的作用是______;装置C中的反应混合溶液![]() 过高或过低将导致产率降低,原因是_______。
过高或过低将导致产率降低,原因是_______。
(2)步骤Ⅱ:下列说法正确的是_____。
A 快速蒸发溶液中水分,可得较大晶体颗粒
B 蒸发浓缩至溶液表面出现品晶膜时,停止加热
C 冷却结晶后的固液混合物中加入乙醇可提高产率
D 可选用冷的![]() 溶液作洗涤剂
溶液作洗涤剂
(3)步骤Ⅲ
①滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):
检漏→蒸馏水洗涤→(______)→(______)→(______)→(______)→(______)→开始滴定。
A 烘干 B 装入滴定液至零刻度以上 C 调整滴定液液面至零刻度或零刻度以下D 用洗耳球吹出润洗液 E 排除气泡 F 用滴定液润洗2至3次 G 记录起始读数
②装标准碘溶液的碘量瓶(带瓶塞的锥形瓶)在滴定前应盖上瓶塞,目的是______。
③滴定法测得产品中![]() 含量为
含量为![]() ,则
,则![]() 产品中可能混有的物质是________。
产品中可能混有的物质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于1mol/L的氨水,下列叙述正确的是(忽略溶液混合时的体积变化)( )
A.将标准状况下22.4L氨气溶于1 L水配成溶液,即可得到1mol/L的氨水
B.1mol/L的氨水的质量分数小于1.7%
C.1mol/L的氨水与水等质量混合后,所得氨水的物质的量浓度大于0.5mol/L
D.将1mol/L的氨水与3mol/L的氨水等质量混合后,所得氨水的物质的量浓度为2mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生对SO2与漂粉精的反应进行实验探究:
操作 | 现象 |
取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
| i.液面上方出现白雾; ii.稍后,出现浑浊,溶液变为黄绿色; iii.稍后,产生大量白色沉淀,黄绿色褪去 |
(1)Cl2和Ca(OH)2制取漂粉精的化学方程式是___。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是___。
(3)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HCl小液滴形成,进行如下实验:
A.用湿润的碘化钾淀粉试纸检验白雾,无变化;
B.用硝酸酸化的AgNO3溶液检验白雾,产生白色沉淀。
①实验A目的是___。
②由实验A、B不能判断白雾中含有HC1,理由是___。
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是___。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是__。
②用离子方程式解释现象iii中黄绿色褪去的原因:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据原子结构、元素周期表和元素周期律的知识回答下列问题:
(1)A元素次外层电子数是最外层电子数的![]() ,其外围电子排布图是__________。
,其外围电子排布图是__________。
(2)B是1~36号元素原子核外电子排布中未成对电子数最多的元素,B元素的名称是____,价层电子排布式_________,在元素周期表中的位置是____________。
(3)C元素基态原子的电子排布图是下图中的____(填序号),另一个不能作为基态原子的电子排布图因为它不符合__(填序号)。
①
②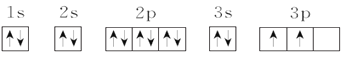
A.能量最低原理 B.泡利原理 C.洪特规则
(4)第三周期元素的气态电中性基态原子失去最外层一个电子转化为气态基态正离子所需的最低能量叫作第一电离能(设为E)。如图所示:
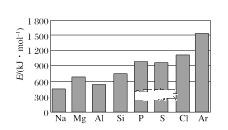
①同周期内,随着原子序数的增大,E值变化的总趋势是____;
②根据图中提供的信息,可推断出E氧____E氟(填“>”“<”或“=”,下同);
③根据第一电离能的含义和元素周期律,可推断出E镁___E钙。
(5)判断BCl3分子的空间构型、中心原子成键时采取的杂化轨道类型及分子中共价键的键角:________、___________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种金属,其焰色反应呈黄色,B溶液能使酚酞试液变红;D、F相遇会产生白烟。A、B、C、D、E、F间有如下变化关系:
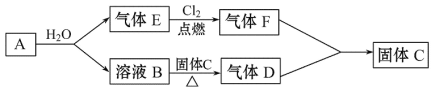
(1)A的名称是___;F的化学式是__。
(2)B→D反应的化学方程式为__。
(3)F在空气中遇水蒸气产生白雾现象,这白雾实际上是__。
(4)已知,气体D也能与Cl2发生反应,试写出当Cl2足量时该反应的化学方程式,并用双线桥法标出电子转移的数目___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)在地壳中含量不大,但砷的化合物却丰富多彩。
(1)基态砷原子的电子排布式为________;砷与溴的第一电离能较大的是____________。
(2)AsH3是无色稍有大蒜味的气体。AsH3的沸点高于PH3,其主要原因是________________________________________________________________。
(3)Na3AsO4可作杀虫剂。AsO43-的空间构型为________,与其互为等电子体的一种分子为________。
(4)某砷的氧化物俗称“砒霜”,其分子结构如图所示。该化合物的分子式为____________,As原子采取________杂化。
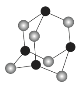
(5)GaAs等是人工合成的新型半导体材料,其晶体结构与金刚石相似,GaAs晶体中,As与Ga之间存在的化学键有________(填字母)。
A.离子键 B.σ键 C.π键 D.氢键 E.配位键 F.金属键 G.极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
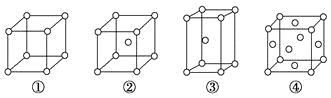
A. ①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示的有机物X可生产S-诱抗素Y(手性碳原子是指连接有四个不同的原子或原子团的碳原子)。下列法正确的是( )。


A. X可以发生氧化、取代、酯化、加聚、缩聚反应,并能与盐酸反应生成有机盐
B. Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色
C. 1mol X与足量NaOH溶液反应,最多消耗4mol NaOH。
D. X结构中有2个手性碳原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com