
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
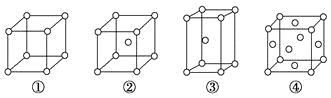
A. ①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】
I.某化学兴趣小组对下列三组物质进行研究:
A.HCl、H2SO4、H2CO3、HNO3
B.溶液、水、悬浊液、胶体
C.Na2CO3、NaNO3、AgNO3、Ba(NO3)2
请你帮他们完善下列空白:
A | B | C | |
分类标准 | 含氧酸 | 分散系 | (3) |
不属于该类别的物质 | (1) | (2) | Na2CO3 |
II.“探险队员”——盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质),盐酸必须避开它们,否则就无法通过。
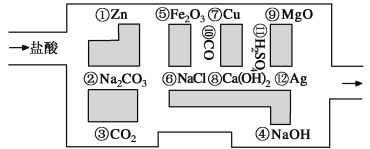
(1)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线):________________。
(2)在能“吃掉”盐酸的化学反应中,属于酸和碱中和反应的有________个,其中能“吃掉”盐酸的盐是____________,写出该反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表达下列反应的离子方程式为( )
A. 用稀盐酸除去水垢:2H++CaCO3===Ca2++CO2↑+H2O
B. 硫化亚铁与浓硫酸混合加热:2H++FeS===H2S↑+Fe2+
C. 向硫酸铝溶液中滴加碳酸钠溶液:2Al3++3CO32-===Al2(CO3)3↓
D. Na2O2溶于水产生O2∶Na2O2+H2O===2Na++2OH-+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高分子材料PET聚酯树脂和PMMA的合成路线如下:

已知:  (R、R′代表烃基)
(R、R′代表烃基)
(1)①的反应类型是____________________。
(2)②的化学方程式为________________________________________。
(3)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为____________。
(4)G的结构简式为____________________。
(5)⑦的化学方程式为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了使宇航员在飞船中得到一个稳定的,良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的装置,它的用途是产生氧气。下列关于Na2O2的叙述正确的是 ( )
A. Na2O2中阴、阳离子的个数比为1∶1
B. Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等
C. Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等
D. Na2O2的漂白原理与SO2的漂白原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.胶体都有丁达尔现象B.向FeCl3溶液中加入KSCN,最终会看到血红色沉淀
C.氢氧化铁胶体可以透过滤纸D.向硫酸铜溶液中加入一小块金属钠,最终会看到蓝色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合溶液中可能含有HCl、MgCl2、AlCl3、NH4Cl、Na2CO3、KCl中的几种物质,往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入的NaOH溶液体积(V)的关系如图所示。回答下列问题:
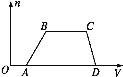
(1)溶液中一定含有的溶质是______________________(填化学式)。
(2)溶液中一定不含有的溶质是________________(填化学式)。
(3)溶液中可能含有的溶质是____(填名称),判断该物质是否存在的实验方法是____,若存在则现象是_______________________________________________。
(4)分别写出AB段、BC段发生反应的离子方程式:
①AB段为_______________________________________________________________;
②BC段为_______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
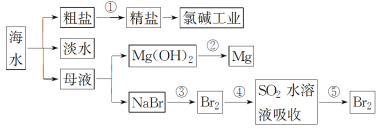
(1)过程①是为了除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,若要除去SO42-,则需要加入的试剂为_____________;若所加的该试剂过量,则可以被后加入的________________除去。
(2)过程②能否一步实现转化?______________(填“能”或“否”),Mg(OH)2与盐酸反应可以得到MgCl2溶液,则该反应的离子方程式为_____________________________________________。
(3)过程④反应的离子方程式为_____________________________________________________。
(4)若用CCl4萃取溴水中的Br2,分液时CCl4层应从分液漏斗的_____________放出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①⑩种元素,填写下列空白:
周期 | IA | IIA | ⅢA | IVA | VA | VIA | ⅦA |
1 | ① | ||||||
2 | ② | ③ | ④ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)上述元素中,形成化合物种类最多的是______(填元素符号)。
(2)元素①、④和⑤形成的化合物的电子式是______,该化合物中存在的化学键类型是______。
(3)②、③、⑦三种元素原子半径由大到小的顺序是______(用元素符号表示)。
⑤、⑥、⑦、⑧、⑨、⑩六种元素形成的简单离子,半径最小的是_________,最大的是___________(填离子符号)。
(4)⑤、⑥、⑦三种元素最髙价氧化物对应水化物的碱性由强到弱的顺序是______(用对应物质的化学式表示)。
(5)最易形成离子键的两种元素代号是_____________。
(6)能比较元素⑨和⑩非金属性强弱的实验事实是______(填字母序号)。
a.⑨的氢化物的酸性比⑩的氢化物的酸性弱
b.⑩的单质R2与H2化合比⑨的单质Q与H2化合容易,且HR的稳定性比H2Q强
c.在⑨的氢化物H2Q的水溶液中通少量⑩的单质R2气体可置换出单质Q
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com