
高炉炼铁中发生的基本反应之一为:FeO(s)+CO(g) Fe(s)+CO2(g)ΔH>0,已知1 373 K时K=0.263。
Fe(s)+CO2(g)ΔH>0,已知1 373 K时K=0.263。
(1)该反应的平衡常数表达式为 。
(2)温度升高,化学平衡移动后,平衡常数K值 (填“增大”、“减小”或“不变”)。
(3)1 373 K时测得高炉中c(CO2)=0.025 mol/L,c(CO)=0.1 mol/L,在这种情况下,该反应是否处于化学平衡状态 (填“是”或“否”)。此时,化学反应速率v(正) v(逆)(填“大于”、“等于”或“小于”),其原因是 。
科目:高中化学 来源:2014年化学高考题型专练六 盖斯定律应用与热化学方程式的书写练习卷(解析版) 题型:选择题
已知:H+(aq)+OH-(aq)=H2O(l) ΔH1=-57.3 kJ·mol-1,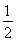 H2SO4(浓,aq)+NaOH(aq)=
H2SO4(浓,aq)+NaOH(aq)=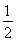 Na2SO4(aq)+H2O(l) ΔH2=m kJ·mol-1。下列说法正确的是 ( )。
Na2SO4(aq)+H2O(l) ΔH2=m kJ·mol-1。下列说法正确的是 ( )。
A.上述热化学方程式中的化学计量数表示分子个数
B.ΔH1>ΔH2
C.ΔH2=-57.3 kJ·mol-1
D.|ΔH1|>|ΔH2|
查看答案和解析>>
科目:高中化学 来源:2014年化学高考题型专练七 电化学理论的分析及应用练习卷(解析版) 题型:选择题
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。以下说法正确的是 ( )。
A.电池工作时,MnO2失去电子
B.电池工作时,电子由锌经外电路流向MnO2
C.从反应方程式来看,不使用氢氧化钾,也不影响电流大小
D.电池的正极反应式为2MnO2(s)+H2O(l)+2e-=Mn2O3(s)+2OH-(aq)
查看答案和解析>>
科目:高中化学 来源:2014年化学高考课时演练10甲烷乙烯苯煤石油天然气的综合利用练习卷(解析版) 题型:选择题
乙酸分子中的O都是18O,乙醇分子中的O都是16O,二者在一定条件下反应所得生成物中水的相对分子质量是( )
A.16 B.18 C.20 D.22
查看答案和解析>>
科目:高中化学 来源:2014年化学高考课时演练10甲烷乙烯苯煤石油天然气的综合利用练习卷(解析版) 题型:选择题
下列化合物的分子中,所有原子都处于同一平面的是( )
A.乙烷B.甲苯C.氟苯D.氯乙烷
查看答案和解析>>
科目:高中化学 来源:2014年化学高考课时演练 7-3化学平衡常数化学反应进行方向练习卷(解析版) 题型:选择题
某温度下,对于反应N2(g)+3H2(g) 2NH3(g)ΔH=-92.4 kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是( )
2NH3(g)ΔH=-92.4 kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是( )

A.将1 mol氮气、3 mol氢气,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ
B.平衡状态由A变到B时,平衡常数K(A)<K(B)
C.上述反应在达到平衡后,增大压强,H2的转化率增大
D.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练9-2电解池金属电化学腐蚀与防护练习卷(解析版) 题型:填空题
请分析下列有关铝盐溶液电解时的变化情况。
(1)用石墨作电极,用如图装置电解AlCl3溶液,两极均产生气泡,阴极区有沉淀生成。持续电解,在阴极附近的溶液中还可观察到的现象是 ,解释此现象的离子方程式是 。

(2)若用石墨作电极电解NaCl和Al2(SO4)3的混合溶液,混合溶液中二者的物质的量浓度分别为3 mol·L-1、0.5 mol·L-1,则下列表示电解过程的曲线正确的是 。

查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练3-4金属材料用途 金属矿物利用练习卷(解析版) 题型:选择题
把95 g含有某一种氯化物杂质的氯化镁粉末溶于水后,与足量AgNO3溶液反应,生成300 g AgCl沉淀,则该氯化镁中的杂质可能是( )
A.NaCl B.AlCl3 C.KCl D.CaCl2
查看答案和解析>>
科目:高中化学 来源:2014年化学高考总复习课时演练 8-3盐类的水解练习卷(解析版) 题型:选择题
室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是( )

A.a点由水电离出的c(H+)=1×10-14 mol/L
B.b点:c(NH4+)+c(NH3·H2O)=c(Cl-)
C.c点:c(Cl-)=c(NH4+)
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com