
【题目】下列图象能正确地表达可逆反应3A(g)+B(g) 2C(g)(ΔH<0)的是 ( )
A.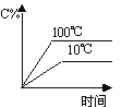 B.
B.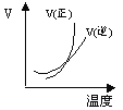
C.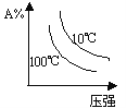 D.
D.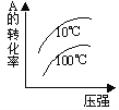
【答案】D
【解析】
对于可逆反应3A(g)+B(g)2C(g)△H<0,反应放热,升高温度,正、逆反应速率都增大,逆反应速率增大更多,平衡向逆反应方向移动,则C%降低,A%增大,A的转化率降低;反应物的化学计量数之和大于生成物的化学计量数之和,增大压强,平衡向正反应方向移动,则C%增大,A%降低,A的转化率增大,以此解答该题。
根据上述分析可知,
A. 由图象可知,温度升高,C%增大,说明升高温度平衡向正反应移动,图象与实际不相符,A项错误;
B. 由图象可知,温度升高,正反应速率增大比逆反应速率增大更多,平衡向正反应移动,图象与实际不相符,B项错误;
C. 由图象可知,压强越大A%降低,平衡向正反应移动,升高温度A%降低,平衡向正反应移动,图象与实际不相符,C项错误;
D. 由图象可知,压强越大A转化率增大,平衡向正反应移动,升高温度A的转化率降低,平衡向逆反应移动,图象与实际相符,D项正确;
答案选D。


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
【题目】已知乙醇、石墨和氢气的燃烧热分别为a、b、c(均为正值,单位均为kJ·mol-1)。则反应2C(s,石墨)+2H2(g)+H2O(l)==C2H5OH(l)的焓变为( )
A. (2b+2c-a) kJ·mol-1 B. (b+c-a) kJ·mol-1
C. (a-2b-2c) kJ·mol-1 D. (a-2b-c) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸锶[Sr(NO3)2]常作为制备焰火、信号弹的原料。实验室以生产碳酸锶工厂的废渣(含SrCO338.40%,SrO12.62%,CaCO338.27%,BaCO32.54%,MgCO31.88%,其它不溶于硝酸的杂质6.29%)为原料制备硝酸锶粗品的部分实验过程如下:

表3 两种盐的溶解度(g/100g水)

(1)废渣粉碎的目的是_____。
(2)由浸取后得到的混合物制备硝酸锶粗品的实验步骤依次为:①__;②__;③__;④洗涤,干燥。
(3)制得的硝酸锶粗品中含有少量Ca(NO3)2、Ba(NO3)2等杂质。实验室测定硝酸锶纯度的实验步骤如下:准确称取一定质量的硝酸锶样品,加入1∶1无水乙醇与乙醚的混合液萃取硝酸钙,用水溶解分离硝酸钙后的样品,于250mL容量瓶中定容得样品溶液。准确移取25.00mL样品溶液,调节pH为7,加入指示剂,加热至微沸,立即用碳酸钠标准溶液滴定至终点。另取样品溶液用比浊法测得硝酸钡的含量。滴定过程中反应的离子方程式为:Sr2++CO32-=SrCO3↓, Ba2++CO32-=BaCO3↓。
①滴定选用的指示剂为_____,滴定终点观察到的现象为_____。
②若滴定前样品中Ca(NO3)2没有除尽,所测定的硝酸锶纯度将会_____(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高效净水剂聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6-n]m,该物质广泛应用于日常生活用水和工业废水的净化处理。某工厂欲以工业废料(金属铁、铝及其氧化物)为原料、采用如下流程来制取PAFC:
![]()
下列判断无法确定的是
A.PAFC因水解而能净水B.往甲溶液中滴入KSCN溶液后呈血红色
C.试剂X具有氧化性D.乙溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)硫酸生产中,SO2催化氧化生成SO3:
2SO2(g)+O2(g)2SO3(g) ΔH<0某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如下图所示。根据图示回答下列问题:
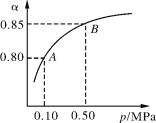
(1)将2.0 mol SO2和1.0 mol O2置于10 L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。该反应的平衡常数等于 ______________________。(不需要写表达式)
(2)平衡状态由A变到B时,平衡常数K(A)___________ K(B)(填“>”、“<”或“=”)。
(3)此反应在恒温密闭的装置中进行,能充分说明此反应已达到平衡的标志是______。
A.接触室中气体的平均相对分子质量不再改变
B.接触室中SO2、O2、SO3的浓度相同
C.接触室中SO2、O2、SO3的物质的量之比为2∶1∶2
D.接触室中压强不随时间变化而变化
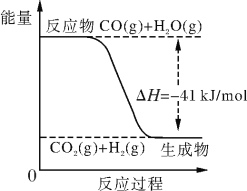
(II)已知工业制氢气的反应为CO(g)+H2O(g) CO2(g)+H2(g),反应过程中能量变化如下图所示。在500 ℃时的平衡常数K=9。若在2 L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。
(4)增加H2O(g)的浓度,CO的转化率将________(填“增大”、“减小”或“不变”)。
(5)平衡常数的表达式K=_______。400 ℃时平衡常数K________9(填“>”、“<” 或“=”)。
(6)已知2H2(g)+O2(g) 2H2O (g) ΔH=-484 kJ/mol。结合上图写出CO完全燃烧生成CO2的热化学方程式:_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)来制备绿矾(FeSO4·7H2O)和聚铁(碱式硫酸铁的聚合物),其过程如下:

(1)若用浓硫酸配制过程①所需的250mL3.0mol·L-1的稀硫酸,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要_____。
(2)过程②用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有_____(填仪器名称),该过程产生的尾气会对大气造成污染,可选用下列试剂中的_____吸收。
a.浓硫酸 b.蒸馏水 c.NaOH溶液 d.浓硝酸
(3)过程③中,需要加入的物质名称是____,检验溶液X中金属阳离子是否完全转化的试剂为_____(填试剂名称)。
(4)过程④的操作是将溶液______、_____、过滤、洗涤,即得到FeSO4·7H2O晶体。过程⑥中,将溶液Z加热到70~80℃,目的是__。
(5)实验室为测定所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取样品2.700g;②将样品溶于足量盐酸后,加入足量的氯化钡溶液;③过滤、洗涤、干燥、称量,得固体质量为3.495g。若该聚铁主要成分为[Fe(OH)SO4]n,则该聚铁中铁元素的质量分数为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
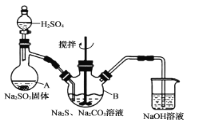
【题目】硫代硫酸钠晶体(Na2S2O35H2O)易溶于水,难溶于乙醇,加热、遇酸均易分解。某实验室模拟工业上制取硫代硫酸钠晶体,反应装置和试剂如图:
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液漏斗的滴速,使反应产生的SO2气体较均匀地通人Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体。
回答下列问题:
(l)仪器A的名称是_________________。
(2)三颈烧瓶B中制取Na2S2O3反应的总化学方程式为_________________________________。
(3)从上述生成物混合液中获得较高产率Na2S2O3.5H2O的步骤为
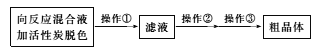
为减少产品的损失,操作①为趁热过滤,“趁热”的目的是_________________________;操作②是蒸发浓缩,冷却结晶;操作③是抽滤、洗涤、干燥。
(4)测定Na2S2O3.5H2O纯度取5.00 g产品,配制成100 mL溶液。取25. 00 mL溶液,以_________为指示剂,用浓度0.100 mol/L的标准溶液进行滴定,反应原理为![]() ,相关数据记录如下表所示。
,相关数据记录如下表所示。
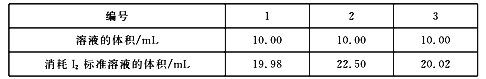
Na2S2035H20的纯度为___________%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢卤酸的能量关系如图所示:下列说法正确的是( )
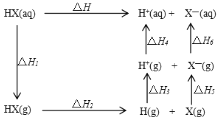
A.已知HF气体溶于水放热,则HF的△H1<0
B.相同条件下,HCl的△H2比HBr的小
C.相同条件下,HCl的(△H3+△H4)比HI的大
D.已知△H>0,对于HF和HCl,都有△H1+△H2>-(△H3+△H4+△H5+△H6)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com