
下列操作正确的是
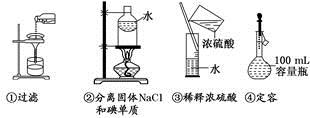
A.只有②
B.②③
C.③④
D.全部错误
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:选择题
下列关于实验操作的叙述正确的是
A.用四氯化碳萃取溴水中的溴时,将溴的四氣化碳溶液从分液漏斗下口放出
B.用氢氧化钠溶液滴定盐酸的实验中,可通过旋转玻璃活塞调节滴定速率
C.在配制一定物质的量浓度溶液的实验中,若定容时加水超过刻度线应立即用滴管吸出少量水
D.用玻璃棒蘸取溶液滴到放在洁净表面皿上用蒸锻水润湿的pH试纸上,测溶液的pH
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测5 题型:选择题
下列离子或分子在溶液中能大量共存,通入SO2后仍能大量共存的一组是
【选项】
A.K+、Ca2+、Br-、Cl- B.NH3·H2O、SO32-、K+、Na+
C.Fe2+、Na+ 、K+、NO3- D.Na+ 、Mg2+、Cl-、ClO-
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:简答题
已知:硫酸铜溶液中滴入氨基乙酸钠(H2 N—CH2—COONa)即可得到配合物A。其结构如右图:
N—CH2—COONa)即可得到配合物A。其结构如右图:
(1)Cu元素基态原子的外围电子排布式为  。
。
(2)1mol氨基乙酸钠中含有σ键的数目为 。
(3)氨基乙酸钠分解产物之一为二氧化碳,写出二氧化碳的一种等电子体 (写化学式)。已知二氧化碳在水中溶解度不大,却易溶于二硫化碳,请解释原因 。
(4)硫酸根离子的空间构型为 ;已知:硫酸铜灼烧可以生成一种红色晶体,其结构如右图,则该化合物的化学式是 。

查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:选择题
某小组设计电解饱和食 盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是
盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是

A.铜电极附近观察到黄绿色气体
B.石墨电极附近溶液呈红色
C.溶液中的Na+向石墨电极移动
D.铜电极上发生还原反应
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测3 题型:简答题
乙醇汽油含氧量达35%,使燃料燃烧更加充分,使用车用乙醇汽油,尾气排放的CO
和碳氢化合物平均减少30%以上,有效的降低和减少了有害的尾气排放。但是汽车使用乙醇汽油并不能减少NOx的排放,对NOx的有效消除成为环保领域的重要课题。NOx排入空气中,形成酸雨,造成空气污染。NOx中有一种红棕色气体,其溶于水的方程式是 。
(2)已知NO2和N2O4的结构式分别是 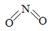 和
和 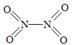 。
。
物质 | NO2 | N2O4 | |
化学键 | N=O | N—N | N=O |
键能(kJ/mol) | 466 | 167 | 438 |
写出NO2转化N2O4的热化学方程式 。
(3)研究人员在汽车尾气系统中装置催化转化剂,可有效降低NOx的排放。
① 写出用CO还原NO生成N2的化学方程式 。
② 在实验室中模仿此反应,在一定条件下的密闭容器中,测得NO转化为N2的转化率随温度变化情况和n (NO)/n(CO)比例变化情况如下图。
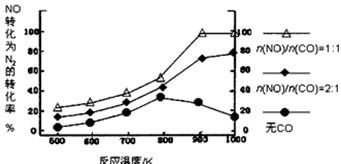
为达到NO转化为N2的最佳转化率,应该选用的温度和n(NO)/n(CO)比例分别 为 、 ;该反应的?H 0(填“>”、“<”或“=”)。
(4)用 CxHy(烃)催化还原NOx也可消除氮氧化物生成无污染的物质。CH4与NO 发生反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测3 题型:选择题
下列叙述不正确的是
A.Li+中含有的中子数与电子数之比为2︰1
B.在C2H6分子中极性共价键与非极性共价键数之比为6︰1
C.常温下,11.2 L的甲烷气体中含有的氢、碳原子数之比为4︰1
D.5.6 g铁与足量的氯气反应失去的电子与参与反应的铁的物质的量之比为2︰1
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测2 题型:选择题
下列说法正确的是
A.欲配制1.00L 1.00mol·L-1的NaCI溶液,可将58.5g NaC1溶于1.00L水中
B.0.2mol Na2O2与足量水反应,转移电子数为0.4NA
C.同温同压下,质量相同的SO2气体和CO2气体的体积比等16:11
D.1.0L 1.0mol ·L-l的Na2CO3水溶液中含有的氧原子数大于2NA
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测16 题型:选择题
1.52 g铜镁合金完全溶解于50 mL密度为1.40 g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120 mL(标准状况)。向反应后的溶液中加入1.0 mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54 g沉淀。下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2?1
B.该浓硝酸中HNO3的物质的量浓度是14.0 mol/L
C.得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL
D.NO2和N2O4的混合气体中,NO2的体积分数是80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com