
乙醇汽油含氧量达35%,使燃料燃烧更加充分,使用车用乙醇汽油,尾气排放的CO
和碳氢化合物平均减少30%以上,有效的降低和减少了有害的尾气排放。但是汽车使用乙醇汽油并不能减少NOx的排放,对NOx的有效消除成为环保领域的重要课题。NOx排入空气中,形成酸雨,造成空气污染。NOx中有一种红棕色气体,其溶于水的方程式是 。
(2)已知NO2和N2O4的结构式分别是 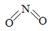 和
和 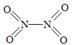 。
。
物质 | NO2 | N2O4 | |
化学键 | N=O | N—N | N=O |
键能(kJ/mol) | 466 | 167 | 438 |
写出NO2转化N2O4的热化学方程式 。
(3)研究人员在汽车尾气系统中装置催化转化剂,可有效降低NOx的排放。
① 写出用CO还原NO生成N2的化学方程式 。
② 在实验室中模仿此反应,在一定条件下的密闭容器中,测得NO转化为N2的转化率随温度变化情况和n (NO)/n(CO)比例变化情况如下图。
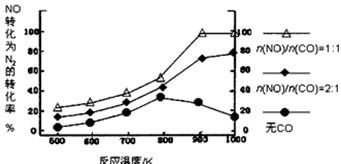
为达到NO转化为N2的最佳转化率,应该选用的温度和n(NO)/n(CO)比例分别 为 、 ;该反应的?H 0(填“>”、“<”或“=”)。
(4)用 CxHy(烃)催化还原NOx也可消除氮氧化物生成无污染的物质。CH4与NO 发生反应的化学方程式为 。
(1)3NO2+H2O=2HNO3+NO
(2)2NO2(g) = N2O4( g) ?H= -55 kJ/mol
g) ?H= -55 kJ/mol
(3)① 2CO+2NO N2+2CO2
N2+2CO2
②900K; n(NO)/n(CO)=1∶1;>
(4)CH4+4NO 2N2+CO2+2H2O
2N2+CO2+2H2O
【解析】(1)二氧化氮与水反应方程式为,3NO2+H2O=2HNO3+NO。
(2)二氧化氮转化为四氧化二氮的反应热可通过键计算出?H=2×2×466-(4×436+167)=-55kJ/mol,2NO2(g) = N2O4( g) ?H=-55 kJ/mol;
g) ?H=-55 kJ/mol;
(3)① 2CO+2NO N2+2CO2
N2+2CO2
②由图可知,900K时转化率达到100%,此时n(NO)/n(CO)=1∶1,随着温度升高,NO的转化率增大,说明升高向正向移动,正反应是吸热反应,?H>0;
(4)无污染生成,则CH4+4NO 2N2+CO2+2H2O。
2N2+CO2+2H2O。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源:2014高考名师推荐化学--预测7 题型:选择题
用选项中的电极、溶液和如图所示装置可组成原电池。下列现象或结论叙述正确的是
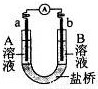
选项 | 电极a | 电极b | A溶液 | B溶液 | 现象或结论 |
A | Cu | Zn | CuSO4 | ZnSO4 | 一段时间后,a增加的质量与b减少的质量相等 |
B | Cu | Zn | 稀H2SO4 | ZnSO4 | 盐桥中阳离子向b极移动 |
C | C | C | FeCl3 | KI、淀粉混 合液 | b极附近溶液变蓝 |
D | Fe | C | NaCl | FeCl3 | 外电路电子转移方向:b→a |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测5 题型:选择题
下列说法正确的是
A.铝热反应是炼铁最常用的方法
B.高纯度的硅单质用于制作光导纤维
C.二氧化氯具有强化性,可用于自来水的杀菌消毒
D.二氧化硅不与任何酸反应,可用石英制造耐酸容器
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测4 题型:选择题
下列实验现象与对应结论均正确的是
选项 | 操作 | 现象 | 结论 |
A | 常温下将Cu片放入浓H2SO4中 | 生成刺激性气味气体 | Cu与浓H2SO4反应生成SO2 |
B | Al2(SO4)3 | 生成白色沉淀 | Al(OH)3不溶于氢氧化钡溶液 |
C | 向某溶液中加入KSCN溶液,再向溶液中加入新制氯水 | 溶液先不显红色,加入氯水后变红色 | 该溶液中含有Fe2+ |
D | 向某溶液中加入CCl4,振荡后静置 | 液体分层,下层呈紫红色 | 该溶液中存在I- |
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测3 题型:填空题
草酸具莽有抗炎、镇痛作用,还可作为合成抗病毒和抗癌药物的中间体.莽草酸可以实现下列转化: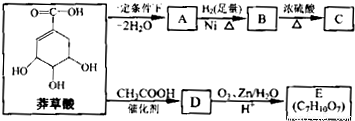
已知:①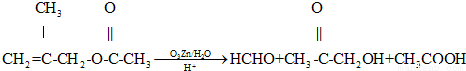
请回答下列问题;
(1)A的结构简式是 ;
(2)B→C的化学方程式是 ,反应类型是 ;
(3)在有机物分子中,若碳原子连接四个不同的原子或原子团,该碳原予称为手性碳原子.E分子中手性碳原子有 个;
(4)莽草酸经过中间产物D合成E的目的是 ;
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测3 题型:选择题
下列说法或表达正确的是
A.氢氧化钠、氯化氢气体、氯化银都是电解质
B.AlCl3的熔点仅190 ℃而Al2O3的熔点为2050 ℃,因此熔融电解法冶炼铝使用AlCl3比Al2O3更好
C.向沸腾的NaOH溶液中滴加FeCl3饱和溶液, 可以制备Fe(OH)3胶体
D.足量氯气通入溴化亚铁溶液中:2Fe2++Cl2=2Cl-+2Fe3+
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测2 题型:选择题
周期表中前20号元素X、Y、Z。已知:X+和Y-两种离子具有相同的电子层结构;Z元素原子核·内质子数比Y 元素原子核内质子数少9个,Y和Z两元素可以形成含有42个电子的负一价阴离子。下列有关说法正确的是
元素原子核内质子数少9个,Y和Z两元素可以形成含有42个电子的负一价阴离子。下列有关说法正确的是
A.离子半径:X+ >Y-
B.Z元素的最高正化合价与最低负化合价代数和为4
C.X、Y、Z可以形成XYZ、XYZ3、XYZ4等化合物
D.Y的氢化物中存在离子键
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学--预测15 题型:填空题
2013年1月27日百度新闻资讯中报道,活性氧化锌是一种多功能性的新型无机材料,其颗粒大小约在1~100纳米。云南化工冶金研究所采用湿化学法(NPP-法)制备纳米级活性氧化锌,可用各种含锌物料为原料,采用酸浸出锌,经过多次净化除去原料中的杂质,然后沉淀获得碱式碳酸锌,最后焙解获得活性氧化锌,化学工艺流程如下:
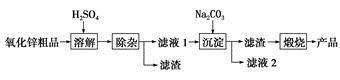
(1)通过________可以检验流程中滤液2中含有Na+。
(2)上述流程图中pH=12的Na2CO3溶液中c(CO32- )=0.50 mol/L,c( HCO3- )=1×10-2 mol/L,则c(Na+)∶c(OH-)=________。
(3)“溶解”后得到的酸性溶液中含有Zn2+、 SO42- ,另含有Fe2+、Cu2+等杂质。先加入________(填“Na2CO3”或“H2SO4”)调节溶液的pH至5.4,然后加入适量KMnO4,Fe2+转化为Fe(OH)3,同时KMnO4转化为MnO2。经检测溶液中Fe2+的浓度为0.009 mol·L-1,则每升溶液中至少应加入________mol KMnO4。
(4)已知常温下,Cu(OH)2的溶度积常数Ksp=2×10-20。溶液中杂质Cu2+浓度为0.002 mol·L-1,若要生成沉淀,则应调节溶液的pH大于________。
(5)“沉淀”得到ZnCO3·2Zn(OH)2·H2O,“煅烧”在450~500 ℃下进行,“煅烧”反应的化学方程式为:_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com