
【题目】某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
醋酸浓度/mol·L-1 | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
(1)写出醋酸的电离方程式:___。
(2)向醋酸溶液中加入一定量的NaOH溶液,当测得溶液的pH=7时,溶液中离子的浓度大小为___。
(3)25℃,将0.1mol/L的CH3COOH溶液和0.1mol/L的NaOH溶液等体积混合后溶液的pH=10,则该混合溶液中由水电离出的c(OH-)=___mol/L,写出该混合溶液中下列算式的精确结果(不能做近似计算),c(Na+)-c(CH3COO-)=__mol/L。
(4)下列方法中,可以使0.10mol·L-1CH3COOH的电离程度增大的是___
a.加入少量0.10mol·L-1的稀盐酸 b.加热CH3COOH溶液 c.加水稀释至0.010mol·L-1 d.加入少量冰醋酸 e.加入少量镁粉 f.加入少量0.10mol·L-1的NaOH溶液
(5)室温时醋酸的电离常数Ka=1.8×10-5,则CH3COO-的水解常数Kh=___。
【答案】CH3COOH![]() CH3COO-+H+ c(Na+)=c(CH3COO—)>c(OH—)=c(H+) 10-4 10-4-10-10 bcef 5.6×10-10
CH3COO-+H+ c(Na+)=c(CH3COO—)>c(OH—)=c(H+) 10-4 10-4-10-10 bcef 5.6×10-10
【解析】
(1)醋酸是弱电解质,在水溶液里部分电离;
(2)pH=7时,溶液呈中性,c(OH-)=c(H+)结合电荷守恒分析;
(3)反应后溶质为醋酸钠,醋酸根离子水解促进了水的电离,溶液中氢氧根离子是水电离的;根据醋酸钠溶液中的电荷守恒计算;
(4)醋酸的电离是吸热反应,加水稀释、加入碱、加热都能促进醋酸的电离;(5)CH3COO-的水解常数Kh=![]() 计算。
计算。
(1)醋酸是弱电解质,在水溶液里部分电离生成醋酸根离子和氢离子,电离方程式为CH3COOHCH3COO-+H+,故答案为:CH3COOHCH3COO-+H+;
(2)向醋酸溶液中加入一定量的NaOH溶液,当测得溶液的pH=7时,溶液呈中性,则c(OH-)=c(H+),结合电荷守恒可知:c(Na+)=c(CH3COO-),溶液中离子的浓度大小为:c(Na+)=c(CH3COO-)>c(OH-)=c(H+),故答案为:c(Na+)=c(CH3COO-)>c(OH-)=c(H+);
(3)25℃,将0.1mol/L的CH3COOH溶液和0.1mol/L的NaOH溶液等体积混合,反应后溶质为醋酸钠,溶液的pH=10,c(H+)=10-10mol/L,则c(OH-)=10-4mol/L,醋酸根离子水解促进了水的电离,溶液中氢氧根离子是水电离的,则该混合溶液中由水电离出的c(OH-)=10-4mol/L,根据电荷守恒可知:c(Na+)-c(CH3COO-)=c(H+)-c(OH-)=(10-4-10-10)mol/Lmol/L,故答案为:10-4;10-4-10-10;
(4)a.加入少量0.10molL-1的稀盐酸,溶液中氢离子浓度增大,抑制醋酸的电离,则醋酸的电离程度降低,故a错误;b.醋酸的电离为吸热过程,加热CH3COOH溶液促进了醋酸的电离,故b正确;c.加水稀释至0.010molL-1,醋酸浓度减小,醋酸的电离程度增大,故c正确;d.加入少量冰醋酸,醋酸的电离平衡向正反应方向移动,但醋酸的电离程度降低,故d错误;e.加入少量镁粉,Mg能够与氢离子反应,醋酸的电离平衡正向移动,电离程度增大,故e正确;f.加入少量0.10molL-1的NaOH溶液,氢离子浓度减小,醋酸的电离平衡正向移动,电离程度增大,故f正确;故答案为:bcef;
(5)根据KhKa=Kw可知,室温时CH3COO-的水解常数Kh=![]() =
=![]() ≈5.6×10-10,故答案为:5.6×10-10。
≈5.6×10-10,故答案为:5.6×10-10。


科目:高中化学 来源: 题型:
【题目】看图回答下列问题。

(1)钢铁的电化学腐蚀原理如图所示:
①该电化学腐蚀称为_____反应的负极反应式:____________
②为了利用电解池原理保护铁电极,要在如图的虚线方框内加上直流电源,铁应与电源的_____(填负或正)极相连,并写出石墨电极的电极反应式________________
③把如图中NaCl溶液用盐酸代替,则石墨电极产生的现象_________
(2)利用电镀原理在铁件表面镀铜。装置如图所示:
①电镀时镀件作______(填阳或阴)极
②A电极的电极反应式是_______
③若电镀前铁、铜两电极的质量相同,电镀完成后将它们取出洗净、烘干、称量, 二者质量差为1.28 g,则电镀时电路中通过的电子为_____________mol。
(3)如图所示进行粗铜(含Al、Zn、Ag、Au等杂质)的电解精炼,下列说法正确的是________
a.阴极得到电子数为![]() 个,则阳极质量减少64g
个,则阳极质量减少64g
b.粗铜接A极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Au金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,体积一定的密闭容器中进行如下可逆反应:X(g)+Y(g)![]() Z(g)+W(s) △H>0,下列叙述正确的是( )
Z(g)+W(s) △H>0,下列叙述正确的是( )
A.该反应平衡常数的表达式为K=![]()
B.平衡后加入X,上述反应的△H增大
C.升高温度,平衡逆向移动
D.当容器中气体压强不变时,反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液)。下列说法中不正确的是
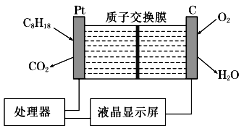
A. 石墨电极作正极,发生还原反应
B. 铂电极的电极反应式为C8H18+16H2O-50e-=8CO2↑+50 H+
C. H+由质子交换膜左侧向右侧迁移
D. 每消耗5.6 L O2,电路中通过1 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气是工农业生产中不可或缺的物质,研究制取氨气的机理意义非凡。
(1)在常温、常压、光照条件下,N2在掺有少量Fe2O3的TiO2催化剂表面与水发生下列反应:
N2(g)+3H2O(l)![]() 2NH3(g)+3/2O2(g) △H= a kJ mol-1。
2NH3(g)+3/2O2(g) △H= a kJ mol-1。
为进一步研究生成NH3的物质的量与温度的关系,常压下达到平衡时测得部分实验数据如下:
T/K | 303 | 313 | 323 |
n(NH3)/(l0-2mol) | 4.8 | 5.9 | 6.0 |
此反应的a_________0,△S________0。(填“>”“<”或“ = ”)
(2)—定温度和压强下,在2 L的恒容密闭容器中合成氨气:N2(g)+3H2(g)![]() 2NH3(g) △H="-92.4" kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
2NH3(g) △H="-92.4" kJ mol-1。在反应过程中反应物和生成物的物质的量随时间的变化如图所示。
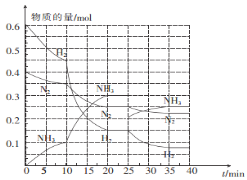
①0~10 min内,以NH3表示的平均反应速率为_________。
②在10~20 min内,NH3浓度变化的原因可能是_______。
A.加入催化剂 B.缩小容器体积 C.降低温度 D.增加NH3的物质的量
③ 20 min达到第一次平衡,在反应进行至25 min时,曲线发生变化的原因是____________,35min达到第二次平衡,则平衡的平衡常数K1______K2(填“>”“<”或“ = ”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处于同一周期的A,B,C,D四种短周期元素,其气态原子获得一个电子所放出的能量大小顺序为![]() 。则下列说法中,正确的是( )
。则下列说法中,正确的是( )
a.元素的非金属性依次增强
b.元素的电负性依次减小
c.元素的第一电离能依次增大
d.最高价氧化物对应水化物的酸性依次减弱
A.adB.bdC.acD.cd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图装置完成表中的四个实验,不能达到实验目的的是
实验装置 | 实验目的 | 试剂X | 试剂Y | |
| A. | 检验C2H5Br消去反应后的气体产物 | 水 | 酸性KMnO4溶液 |
B. | 检验C2H5OH消去反应后的气体产物 | NaOH溶液 | Br2的CCl4溶液 | |
C. | 比较醋酸、碳酸、苯酚酸性强弱 | NaOH溶液 | 苯酚钠溶液 | |
D. | 检验制取乙炔时的气体产物 | CuSO4溶液 | 酸性KMnO4溶液 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有六种元素,其中A、B、C、D、E为短周期主族元素,F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具 |
B元素原子的核外p电子数比s电子数少1 |
C元素基态原子p轨道有两个未成对电子 |
D原子的第一至第四电离能分别是: Ⅰ |
E原子核外所有p轨道全满或半满 |
F在周期表的第8纵列 |
(1)某同学根据上述信息,推断A基态原子的核外最子排布为了![]() ,该同学所画的电子排布图违背了___________。
,该同学所画的电子排布图违背了___________。
(2)![]() 元素的电负性_____
元素的电负性_____![]() 填“大于”、“小于”或“等于”
填“大于”、“小于”或“等于”![]() 元素的电负性。
元素的电负性。
(3)![]() 基态原子中能量最高的电子,其电子云在空间有__________个方向。
基态原子中能量最高的电子,其电子云在空间有__________个方向。
(4)下列关于F原子的价层电子排布图正确的是___________。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(5)基态![]() 离子核外电子排布式为_____________。
离子核外电子排布式为_____________。
(6)元素铜与镍的第二电离能分别为:![]() ,
,![]() ,
,![]() 原因是_________。
原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请用序号填空:
①13C与14C ②正丁烷与异丁烷
③CH3CH3与CH3CH2CH3 ④
(1)属于同位素的是______;
(2)属于同系物的是______;
(3)属于同分异构体的是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com