
【题目】处于同一周期的A,B,C,D四种短周期元素,其气态原子获得一个电子所放出的能量大小顺序为![]() 。则下列说法中,正确的是( )
。则下列说法中,正确的是( )
a.元素的非金属性依次增强
b.元素的电负性依次减小
c.元素的第一电离能依次增大
d.最高价氧化物对应水化物的酸性依次减弱
A.adB.bdC.acD.cd
【答案】B
【解析】
同周期元素气态原子获得一个电子所放出的能量A>B>C>D,说明非金属性A>B>C>D,同周期元素从左到右元素的金属性逐渐降低,则原子序数A>B>C>D,以此解答该题。
a.其气态原子获得一个电子所放出的能量大小顺序,A>B>C>D,非金属性A>B>C>D,故四种元素在周期表中从左到右依次为D、C、B、A,元素的非金属性依次增强,同周期元素A、B、C、D从左到右元素的金属性逐渐降低,故a错误;
b.其气态原子获得一个电子所放出的能量大小顺序,A>B>C>D ,原子对键合电子的吸引力就是电负性,元素的电负性依次减小,故b正确;
c.元素的第一电离能指的是气态电中性基态原子失去一个电子变成气态基态正离子需要的能量,四种元素在周期表中从左到右依次为D、C、B、A,则第一电离能呈现增大的趋势,由于第VA族的元素p轨道电子处于半充满状态,使其第一电离能反常,大于第VIA族元素,例如Si、P、S、Cl,第一电离能Cl>P>S>Si,故c错误;
d.四种元素在周期表中从左到右依次为D、C、B、A,则A、B、C、D的非金属性逐渐减弱,最高价氧化物对应水化物![]() 均存在
均存在![]() 的酸性依次减弱,故d正确;
的酸性依次减弱,故d正确;
故bd正确,答案选B。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】关于乙炔的说法错误的是 ( )
A. 乙炔的键角为180°,是非极性分子
B. 碳原子sp杂化轨道形成σ键、未杂化的两个2p轨道形成两个π键,且互相垂直
C. 碳碳三键中三条键能量大小相同,其键长是碳碳单键的![]()
D. 乙炔分子中既有极性键也有非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
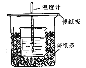
(1)从实验装置上看,图中尚缺少的一种玻璃用品是___。
(2)烧杯间填满碎纸条的作用是___。
(3)大烧杯上如不盖硬纸板,求得的中和热数值___(填“偏大”、“偏小”、“无影响”)。
(4)实验中60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量___(填“相等”、“不相等”),所求中和热___(填“相等”、“不相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】位于同一周期的四种短周期非金属元素A、B、C、D,其原子对键合电子的吸引力由大到小的顺序为![]() 。下列有关元素A、B、C、D的说法正确的是 ( )
。下列有关元素A、B、C、D的说法正确的是 ( )
a.元素的非金属性依次增强;
b.元素的电负性依次减小;
c.元素的第一电离能依次增大;
d.最高价氧化物对应水化物![]() 均存在
均存在![]() 的酸性依次减弱。
的酸性依次减弱。
A.adB.bdC.acD.cd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。用pH计测定25℃时不同浓度的醋酸的pH,其结果如下:
醋酸浓度/mol·L-1 | 0.0010 | 0.0100 | 0.0200 | 0.1000 | 0.2000 |
pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
(1)写出醋酸的电离方程式:___。
(2)向醋酸溶液中加入一定量的NaOH溶液,当测得溶液的pH=7时,溶液中离子的浓度大小为___。
(3)25℃,将0.1mol/L的CH3COOH溶液和0.1mol/L的NaOH溶液等体积混合后溶液的pH=10,则该混合溶液中由水电离出的c(OH-)=___mol/L,写出该混合溶液中下列算式的精确结果(不能做近似计算),c(Na+)-c(CH3COO-)=__mol/L。
(4)下列方法中,可以使0.10mol·L-1CH3COOH的电离程度增大的是___
a.加入少量0.10mol·L-1的稀盐酸 b.加热CH3COOH溶液 c.加水稀释至0.010mol·L-1 d.加入少量冰醋酸 e.加入少量镁粉 f.加入少量0.10mol·L-1的NaOH溶液
(5)室温时醋酸的电离常数Ka=1.8×10-5,则CH3COO-的水解常数Kh=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了某短周期元素R的各级电离能数据![]() 用
用![]() 、
、![]() 表示,单位为
表示,单位为![]() 。下列关于元素R的判断中一定正确的是
。下列关于元素R的判断中一定正确的是 ![]()
![]()
|
|
|
|
|
|
|
R | 740 | 1500 | 7700 | 10500 | 13600 |
|
a.![]() 的最高正价为
的最高正价为![]() 价
价
b.![]() 元素位于元素周期表中第ⅡA族
元素位于元素周期表中第ⅡA族
c.![]() 元素第一电离能大于同周期相邻元素
元素第一电离能大于同周期相邻元素
d.![]() 元素的原子最外层共有4个电子
元素的原子最外层共有4个电子
e.![]() 元素基态原子的电子排布式为
元素基态原子的电子排布式为![]()
A.acB.bcC.bcdD.bce
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 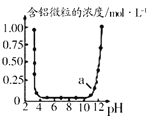 表示
表示![]() 与
与![]() 反应时含铝微粒浓度变化曲线,图中a点溶液中含大量
反应时含铝微粒浓度变化曲线,图中a点溶液中含大量![]()
B. 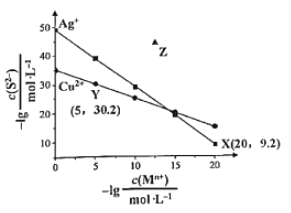 可知
可知![]() 平衡常数很大,反应趋于完全
平衡常数很大,反应趋于完全
C. 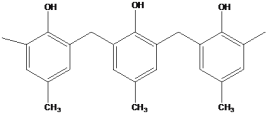 为一种高分子结构片断,可知该高分子的结构简式为
为一种高分子结构片断,可知该高分子的结构简式为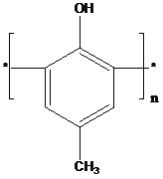
D.  反应①比反应②的速率慢,与相应正反应的活化无关
反应①比反应②的速率慢,与相应正反应的活化无关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据原子结构知识回答:
(1)![]() 基态原子的电子排布式是_______________________________;S的价层电子排布式是_________________。
基态原子的电子排布式是_______________________________;S的价层电子排布式是_________________。
(2)基态的![]() 原子有______ 个未成对电子,
原子有______ 个未成对电子,![]() 的外围电子排布图为______________。
的外围电子排布图为______________。
(3)四种元素![]() 、K、O、
、K、O、![]() 中第一电离能最小的是 _____,电负性最大的是 ______。
中第一电离能最小的是 _____,电负性最大的是 ______。
(4)下列有关微粒性质的排列顺序中,错误的是 ______ 。
A.元素的电负性:![]()
![]() 元素的第一电离能:
元素的第一电离能:![]()
C.离子半径:![]()
![]() 原子的未成对电子数:
原子的未成对电子数:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:AgBr比AgCl更难溶,将AgCl与AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,发生的反应为
A. 只有AgBr沉淀生成 B. AgCl与AgBr沉淀等量生成
C. AgCl与AgBr沉淀都有,但以AgCl沉淀为主 D. AgCl与AgBr沉淀都有,但以AgBr沉淀为主
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com