
【题目】依据原子结构知识回答:
(1)![]() 基态原子的电子排布式是_______________________________;S的价层电子排布式是_________________。
基态原子的电子排布式是_______________________________;S的价层电子排布式是_________________。
(2)基态的![]() 原子有______ 个未成对电子,
原子有______ 个未成对电子,![]() 的外围电子排布图为______________。
的外围电子排布图为______________。
(3)四种元素![]() 、K、O、
、K、O、![]() 中第一电离能最小的是 _____,电负性最大的是 ______。
中第一电离能最小的是 _____,电负性最大的是 ______。
(4)下列有关微粒性质的排列顺序中,错误的是 ______ 。
A.元素的电负性:![]()
![]() 元素的第一电离能:
元素的第一电离能:![]()
C.离子半径:![]()
![]() 原子的未成对电子数:
原子的未成对电子数:![]()
【答案】![]()
![]() 4
4 ![]() K F B
K F B
【解析】
(1)根据构造原理,写出核外电子排布式;
(2)根据核外电子排布式回答;
(3)根据元素周期律中第一电离能和电负性的递变规律回答;
(4)根据元素周期律判断。
(1)![]() 元素为14号元素,原子核外有14个电子,则核外电子排布式为:
元素为14号元素,原子核外有14个电子,则核外电子排布式为:![]() ;S元素为16号元素,原子核外有16个电子,所以核外电子排布式为:
;S元素为16号元素,原子核外有16个电子,所以核外电子排布式为:![]() ,则S的价层电子排布式为:
,则S的价层电子排布式为:![]() ;
;
(2)![]() 为26号元素,原子核外有26个电子,Fe基态原子电子排布式为
为26号元素,原子核外有26个电子,Fe基态原子电子排布式为![]() ,则原子有4个未成对电子;Fe元素的价电子为3d和4s上电子,亚铁离子核外有24个电子,
,则原子有4个未成对电子;Fe元素的价电子为3d和4s上电子,亚铁离子核外有24个电子,![]() 的外围电子排布式为
的外围电子排布式为![]() ,其外围电子排布图为
,其外围电子排布图为![]() ;
;
(3)元素的金属性越强,其第一电离能越小,则四种元素![]() 、K、O、
、K、O、![]() 中K的第一电离能最小;元素的非金属性越强,其电负性越大,所以F的电负性最大;
中K的第一电离能最小;元素的非金属性越强,其电负性越大,所以F的电负性最大;
(4)A.得电子能力![]() ,所以元素的电负性
,所以元素的电负性![]() ,故A正确;
,故A正确;
B.C的电子排布式:![]() ,N的电子排布式:
,N的电子排布式:![]() ,p轨道处于半充满状态,O的电子排布式:
,p轨道处于半充满状态,O的电子排布式:![]() ,第一电离能应该是N的最大,则元素的第一电离能:
,第一电离能应该是N的最大,则元素的第一电离能:![]() ,故B错误;
,故B错误;
C.电子层数相同核电荷数越多半径越小,则离子半径:![]() ,故C正确;
,故C正确;
D.Mn、Si、Cl原子的未成对电子数分别为5、2、1,即原子的未成对电子数:![]() ,故D正确;
,故D正确;
故答案为B。


科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A. 已知2SO2(g)+O2(g)![]() 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B. 已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C. 已知H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ/mol,代表任何酸碱反应的中和热都是ΔH=-57.3 kJ/mol
D. 已知2C(s)+2O2(g)=2CO2(g) ΔH1,2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处于同一周期的A,B,C,D四种短周期元素,其气态原子获得一个电子所放出的能量大小顺序为![]() 。则下列说法中,正确的是( )
。则下列说法中,正确的是( )
a.元素的非金属性依次增强
b.元素的电负性依次减小
c.元素的第一电离能依次增大
d.最高价氧化物对应水化物的酸性依次减弱
A.adB.bdC.acD.cd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法全部正确的一组是( )
①CH3—CH=CH2和环己烷的最简式相同
②乳酸薄荷醇酯(![]() )能发生水解、氧化、消去反应
)能发生水解、氧化、消去反应
③碳原子数不同的直链烷烃一定是同系物 ④正戊烷、异戊烷、新戊烷的沸点逐渐变低
⑤标准状况下,11.2 L的己烷所含的分子数为0.5NA(NA为阿伏加德罗常数)
⑥用核磁共振氢谱不能区分HCOOCH3和HCOOCH2CH3
⑦分子式为C9H12的苯的同系物,若苯环上只有一个取代基,则其一溴代物有11种
⑧欲除去乙烷中混有的乙烯,可选用酸性KMnO4溶液洗气
A.①②③④⑦B.②③④⑥C.②③⑥D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有六种元素,其中A、B、C、D、E为短周期主族元素,F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题。
A元素形成的物质种类繁多,其形成的一种固体单质工业上常用作切割工具 |
B元素原子的核外p电子数比s电子数少1 |
C元素基态原子p轨道有两个未成对电子 |
D原子的第一至第四电离能分别是: Ⅰ |
E原子核外所有p轨道全满或半满 |
F在周期表的第8纵列 |
(1)某同学根据上述信息,推断A基态原子的核外最子排布为了![]() ,该同学所画的电子排布图违背了___________。
,该同学所画的电子排布图违背了___________。
(2)![]() 元素的电负性_____
元素的电负性_____![]() 填“大于”、“小于”或“等于”
填“大于”、“小于”或“等于”![]() 元素的电负性。
元素的电负性。
(3)![]() 基态原子中能量最高的电子,其电子云在空间有__________个方向。
基态原子中能量最高的电子,其电子云在空间有__________个方向。
(4)下列关于F原子的价层电子排布图正确的是___________。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(5)基态![]() 离子核外电子排布式为_____________。
离子核外电子排布式为_____________。
(6)元素铜与镍的第二电离能分别为:![]() ,
,![]() ,
,![]() 原因是_________。
原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图分别表示冰晶体、干冰晶体、金刚石晶体的结构,下列关于这些晶体的说法正确的是
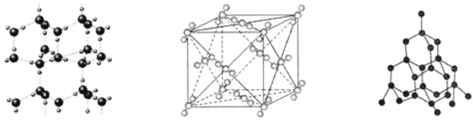
A.冰晶体中只存在范德华力和氢键两种作用力
B.沸点:金刚石![]() 干冰
干冰![]() 冰
冰
C.冰晶体中的氧原子和金刚石中的碳原子均可形成四面体结构
D.干冰晶体中每个![]() 周围距离相等且最近的
周围距离相等且最近的![]() 有10个
有10个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际上至今发现具有巨磁电阻效应的20多种金属纳米多层膜中,其中三种是我国学者发现的,Mn和Bi形成的晶体薄膜是一种金属间化合物(晶胞结构如右图),有关说法正确的是( )
A.锰价电子排布为3d74s0
B.Bi是d区金属
C.该晶体的化学式为MnBi
D.该合金堆积方式是简单立方
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.![]() 电子排布式
电子排布式![]()
B.在金属晶体中,自由电子与金属离子或金属原子的碰撞有能量传递,可以用此来解释的金属的物理性质是导热性
C.金属键可以看做是许多原子共用许多电子所形成的强烈相互作用,所以和共价键类似,也有饱和性和方向性
D.某物质的晶体中含A、B、C三种元素,其排列方式如图所示,晶胞中A、B、C的原子个数比为1:2:2.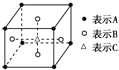
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A. 已知2H2(g)+O2(g) =2 H2O(g) △H=-483.6kJ·mol-1,则氢气的燃烧热△H=-241.8 kJ/mol
B. 已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2
C. 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq) = CH3COONa(aq) + H2O(l) △H =-57.4kJ·mol-1
D. CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g)=2CO(g)+O2(g) △H=+566.0 kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com