
【题目】下列依据热化学方程式得出的结论正确的是( )
A. 已知2SO2(g)+O2(g)![]() 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B. 已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C. 已知H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ/mol,代表任何酸碱反应的中和热都是ΔH=-57.3 kJ/mol
D. 已知2C(s)+2O2(g)=2CO2(g) ΔH1,2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2
【答案】D
【解析】
A.放热反应中反应物的总能量大于生成物的总能量,所以2molSO2(g)和1molO2(g)的总能量大于2molSO3(g)的总能量,但不能说SO2的能量高于SO3的能量,故A错误;
B.已知C(石墨,s)=C(金刚石,s);△H>0,反应是吸热反应,石墨转化为金刚石吸收能量,则金刚石的能量高于石墨,能量越高越不稳定,所以石墨比金刚石稳定,故B错误;
C.在稀溶液中强酸和强碱反应生成1mol水放出的热量为中和热,△H=-57.3kJ/mol,酸碱中和反应的热效应不仅与生成H2O的物质的量有关,还与酸、碱的浓度及强弱有关,故C错误;
D.已知2C(s)+2O2(g)=2CO2(g) △H1,2C(s)+O2(g)=2CO(g) △H2,碳完全燃烧比不完全燃烧放出的能量多,焓变是负值,比较ΔH时应带符号比较,故ΔH1<ΔH2,故D正确。
故选D。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列有关细胞中水的叙述,错误的是
A. 细胞内参与物质运输的水是自由水
B. 越冬的动物体内结合水的比例相对较高
C. 同一个体的不同器官的含水量相同
D. 植物蒸腾作用中失去的水主要是自由水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯化反应是酸与醇反应生成酯和水的反应,如乙酸与乙醇在浓硫酸催化作用下生成乙酸乙酯和水的反应就是酯化反应。下列关于酯化反应的说法正确的是( )
A.属于中和反应
B.属于取代反应
C.酸分子中去氢原子
D.醇分子中去羟基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列关于充电电池、干电池的叙述合理的是___________。
①干电池可以实现化学能向电能的转化和电能向化学能的转化
②锌锰干电池长时间连续使用时内装糊状物可能流出腐蚀电器
③充电电池可以无限制地反复放电、充电
④充电是使放电时的氧化还原反应逆向进行
(2)铅蓄电池中,正极材料为PbO2,负极材料为Pb,放电时其负极反应式为_____________。
(3)原电池在NaOH溶液介质中,铝为负极,其负极反应式为_______________。
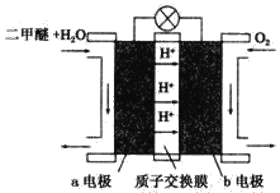
(4)如图为绿色电源“二甲醚(CH3OCH3)燃料电池”的工作原理示意图。b电极是_____极,请写出负极的电极反应方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是( )
A. 标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA
B. 25 ℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA
C. 标准状况下,4.48 L SO3所含的分子数目为0.2NA
D. 常温常压下,16gO2和O3混合气体含有的氧原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入物质的量浓度均0.1mol·L-1的CH4与CO2,在一定条件下发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图5,下列有关说法正确的是( )
2CO(g)+2H2(g),测得CH4的平衡转化率与温度及压强的关系如图5,下列有关说法正确的是( )

A. 上述反应的△H>0 B. 压强P1>P2>P3>P4
C. 1100℃该反应的平衡常数为64 D. 压强为P4时,在Y点:v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可以通过不同化学反应分别制得B、C和D三种物质,结构简式如图所示:

(1)A的分子式是____;B中的含氧官能团名称是____。
(2)A→B的反应类型是____;A~D中互为同分异构体的是_____(填代号)。
(3)D在酸性条件下水解的化学方程式是____。
(4)检验B中醛基的方法____。
(5)符合下列条件的A的同分异构体有____种。
①官能团种类不变且与苯环直接相连;②苯环上只有三个取代基。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图图装置测定中和热的实验步骤如下:
| ①用量筒量取50 mL 0.50mol·L-l盐酸倒入小烧杯中,测出盐酸温度; ②用另一量筒量取50mL 0.55mol/L NaOH溶液,并用另一温度计测出其温度; ③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液的最高温度。 |
回答下列问题:
(1)倒入NaOH溶液的正确操作是______________。
A.沿玻璃缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是______________。
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒轻轻地搅动
(3)做了三次实验,每次取溶液各50 mL,并将实验数据记录如下:

已知盐酸、NaOH溶液的密度与水相同,中和后生成的溶液的比热容c=4. 2×10-3kJ/(g·℃),则该反应的中和热△H=____________________________。
(4)若用50 mL 0.55 mol·L-1的氨水(NH3·H2O)代替NaOH溶液进行上述实验,通过测得的反应热来计算中和热,测得的中和热△H的绝对值会___________(填“偏小”、“偏大”或“不变”)。
(5)若通过实验测定中和热的△H的绝对值常常小于57.3kJ/mol,其原因可能是______________。
A.实验装置保温、隔热效果差
B.测量HCl溶液的温度计用水洗净后才用来测NaOH溶液的温度
C.量取NaOH溶液的体积时仰视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电池是人类生产和生活中重要的能量来源,电池的发明是化学对人类的一项重大贡献。
(1)依据 NaOH与HCl的反应原理设计原电池,你认为是否可行?________填“是”或“否”),理由是_______________________________________________________________。
(2)理论上讲,任何自发的氧化还原反应都可以设计成原电池。请利用反应“Fe+Cu 2+ =Cu+Fe2+ ”设计一个化学电池(正极材料用碳棒),回答下列问题:
①电池的负极材料是__________,发生_____________反应(填“氧化”或“还原”),电解质溶液是_____________;
②正极上出现的现象是____________________________________________;
③若导线上转移电子1 mol,则生成铜___________克。
(3)设计一个实验方案,使如图装置中的铁棒上析出铜,而铁不溶解(作图表示)。
 ____________
____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com