
【题目】(1)下列关于充电电池、干电池的叙述合理的是___________。
①干电池可以实现化学能向电能的转化和电能向化学能的转化
②锌锰干电池长时间连续使用时内装糊状物可能流出腐蚀电器
③充电电池可以无限制地反复放电、充电
④充电是使放电时的氧化还原反应逆向进行
(2)铅蓄电池中,正极材料为PbO2,负极材料为Pb,放电时其负极反应式为_____________。
(3)原电池在NaOH溶液介质中,铝为负极,其负极反应式为_______________。
(4)如图为绿色电源“二甲醚(CH3OCH3)燃料电池”的工作原理示意图。b电极是_____极,请写出负极的电极反应方程式:___________________________。
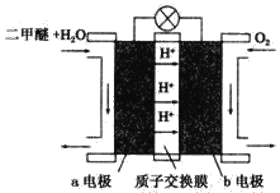
【答案】②④ Pb+SO42--2e-===PbSO4 Al+4OH--3e-===AlO2-+2H2O 正 (CH3)2O﹣12 e-+3H2O === 2CO2+12H+
【解析】
(1)①原电池是把化学能转化为电能的装置,所以锌锰干电池能将化学能转化为电能,但不能完成电能向化学能的转化,故①错误;
②NH4Cl和ZnCl2都是强酸弱碱盐水解呈酸性,所以干电池长时间连续使用时内装糊状物可能流出腐蚀电器,故②正确;
③充电电池属于二次电池,但并不是可以无限制地反复充电、放电,故③错误;
④充电过程的反应物是放电过程的生成物,所以充电是使放电的氧化还原反应逆向进行,故④正确。
所以关于充电电池、干电池的叙述合理的是②④,故答案为:②④。
(2)铅蓄电池放电时其负极反应式为:Pb+SO42--2e-=PbSO4,故答案为:Pb+SO42--2e-=PbSO4。
(3)原电池在NaOH溶液介质中,铝为负极,铝失去电子,且溶液为碱性,则其负极反应式为Al+4OH--3e-=AlO2-+2H2O,故答案为:Al+4OH--3e-=AlO2-+2H2O。
(4)反应本质是二甲醚的燃烧,原电池负极发生氧化反应,二甲醚在负极放电,正极发生还原反应,氧气在正极放电,由图可知,a极为负极,b为正极,二甲醚放电生成二氧化碳与氢离子,a电极的电极反应式为 CH3OCH3-12e-+3H2O═2CO2+12H+,
故答案为:正极;CH3OCH3+3H2O-12e-═2CO2+12H+。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】向10mL![]() NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是
NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是
A. x=10时,溶液中有NH4+、Al3+、SO42-,且c(NH4+)>c(Al3+)
B. x=10时,溶液中有NH4+、AlO2-、SO42-,且 c(NH4+)>c(SO42-)
C. x=30时,溶液中有Ba2+、AlO2-、OH-,且 c(OH-)<c AlO2-)
D. x=30时,溶液中有Ba2+、Al3+、OH-,且 c(OH-)=c(Ba2+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z、M的原子序数依次增大,元素W的一种核素的中子数为0,X的原子最外层电子数是次外层的2倍,Z与M同主族,Z2电子层结构与氖相同。
(1)M位于元素周期表中第______周期______族。
(2)化合物p由W、X、Y、M四种元素组成。已知向p溶液中加入FeCl3溶液,溶液变血红色;向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体。p的化学式为_________。
(3)由X、Y、Z三种元素可组成摩尔质量为84g/mol的物质q,且q分子中三种元素的原子个数之比为1:1:1。已知q分子中各原子均达到8电子稳定结构,且分子中不含双键,但含极性键和非极性键,q分子的结构式为_______________。
(4) (XY)2的性质与Cl2相似,(XY)2与NaOH溶液反应的离子方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)△CuSO4(s)+5H2O(l), 热效应为△H3。则下列判断正确的是
A. △H2>△H3 B. △H1<△H3
C. △H1+△H3=△H2 D. △H1+△H2>△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是( )
A. 已知2SO2(g)+O2(g)![]() 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B. 已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定
C. 已知H+(aq)+OH-(aq)=H2O(l)ΔH=-57.3 kJ/mol,代表任何酸碱反应的中和热都是ΔH=-57.3 kJ/mol
D. 已知2C(s)+2O2(g)=2CO2(g) ΔH1,2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1<ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有某硫酸和硝酸的混合溶液20 mL,其中含硫酸的浓度为2 mol·L-1,含硝酸的浓度为1 mol·L-1,现向其中加入0.96 g铜粉,充分反应后(假设只生成NO气体),最多可收集到标准状况下的气体的体积为( )
A. 224 mLB. 168 mL
C. 112 mLD. 89.6 mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在容积为2 L的密闭容器内进行某一反应,容器内气体X、气体Y的物质的量随反应时间变化的曲线如图所示。据图可知

A. 反应的化学方程式为4Y=X
B. 反应进行到t1时,Y的浓度减少了3 mol·L-1
C. 反应进行到t2时,达到平衡状态
D. 反应进行到t3时,每生成4 mol Y的同时生成1 mol X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com