
【题目】室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)△CuSO4(s)+5H2O(l), 热效应为△H3。则下列判断正确的是
A. △H2>△H3 B. △H1<△H3
C. △H1+△H3=△H2 D. △H1+△H2>△H3
【答案】B
【解析】
试题根据题意知,CuSO4·5H2O(s)溶于水的热化学方程式为CuSO4·5H2O(s)![]() Cu2+(aq)+SO42—(aq)+5H2O(l),△H1>0;CuSO4(s)溶于水的热化学方程式为CuSO4(s)
Cu2+(aq)+SO42—(aq)+5H2O(l),△H1>0;CuSO4(s)溶于水的热化学方程式为CuSO4(s)![]() Cu2+(aq)+SO42—(aq),△H2<0;根据盖斯定律知,CuSO4·5H2O受热分解的热化学方程式为:CuSO4·5H2O(s)
Cu2+(aq)+SO42—(aq),△H2<0;根据盖斯定律知,CuSO4·5H2O受热分解的热化学方程式为:CuSO4·5H2O(s)![]() CuSO4(s)+5H2O(l), △H3=△H1—△H2>0。A、根据上述分析知,△H2<△H3,错误;B、根据上述分析知,△H1<△H3,正确;C、根据上述分析知,△H3=△H1—△H2,错误;D、根据上述分析知,△H1+△H2<△H3,错误。
CuSO4(s)+5H2O(l), △H3=△H1—△H2>0。A、根据上述分析知,△H2<△H3,错误;B、根据上述分析知,△H1<△H3,正确;C、根据上述分析知,△H3=△H1—△H2,错误;D、根据上述分析知,△H1+△H2<△H3,错误。


科目:高中化学 来源: 题型:
【题目】某有机化合物A经李比希法测得其中含碳为70.59%、含氢为 5.88%,其余含有氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的质谱图如图1:

方法二:核磁共振仪测出A的核磁共振氢谱有4个峰,其面积之比为1:2:2:3。如图2。
方法三:利用红外光谱仪测得A分子的红外光谱,如图3。

(1)A的摩尔质量__________。
(2)A的分子式为_____________。
(3)该物质属于哪一类有机物___________。
(4)A的分子中只含一个甲基的依据是________(填序号)。
a.A的相对分子质量 b.A的分子式
c.A的核磁共振氢谱图 d.A分子的红外光谱图
(5)A的结构简式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室回收废水中苯酚的过程如图所示。下列分析错误的是

A. 操作I中苯作萃取剂
B. 苯酚钠在苯中的溶解度比在水中的大
C. 通过操作II苯可循环使用
D. 三步操作均需要分液漏斗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯化反应是酸与醇反应生成酯和水的反应,如乙酸与乙醇在浓硫酸催化作用下生成乙酸乙酯和水的反应就是酯化反应。下列关于酯化反应的说法正确的是( )
A.属于中和反应
B.属于取代反应
C.酸分子中去氢原子
D.醇分子中去羟基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某有机化合物A的结构,进行如下实验:
(1)将一定量的有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2,消耗氧气6.72L(标准状况下),则该物质的实验式是____________。
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图1所示的质谱图,则其相对分子质量为_____________,该物质的分子式是_____________。
(3)请预测A的可能结构并写出结构简式:_____________。
(4)核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如甲基氯甲基醚(ClCH2OCH3,有2种氢原子)的核磁共振氢谱如图2所示:
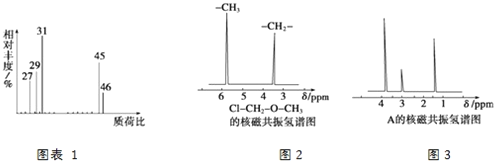
经测定,有机物A的核磁共振氢谱图如图3所示,则A的结构简式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列关于充电电池、干电池的叙述合理的是___________。
①干电池可以实现化学能向电能的转化和电能向化学能的转化
②锌锰干电池长时间连续使用时内装糊状物可能流出腐蚀电器
③充电电池可以无限制地反复放电、充电
④充电是使放电时的氧化还原反应逆向进行
(2)铅蓄电池中,正极材料为PbO2,负极材料为Pb,放电时其负极反应式为_____________。
(3)原电池在NaOH溶液介质中,铝为负极,其负极反应式为_______________。
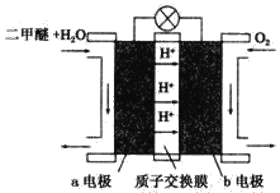
(4)如图为绿色电源“二甲醚(CH3OCH3)燃料电池”的工作原理示意图。b电极是_____极,请写出负极的电极反应方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是( )
A. 标准状况下,0.1 mol Cl2溶于水,转移的电子数目为0.1NA
B. 25 ℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA
C. 标准状况下,4.48 L SO3所含的分子数目为0.2NA
D. 常温常压下,16gO2和O3混合气体含有的氧原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可以通过不同化学反应分别制得B、C和D三种物质,结构简式如图所示:

(1)A的分子式是____;B中的含氧官能团名称是____。
(2)A→B的反应类型是____;A~D中互为同分异构体的是_____(填代号)。
(3)D在酸性条件下水解的化学方程式是____。
(4)检验B中醛基的方法____。
(5)符合下列条件的A的同分异构体有____种。
①官能团种类不变且与苯环直接相连;②苯环上只有三个取代基。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.已知C1O2是易溶于水难溶于有机溶剂的气体,常用于自来水消毒。实验室制备C1O2是用亚氯酸钠固体与氯气反应:2NaClO2+C12==2C1O2+2NaCl,装置如下图所示:
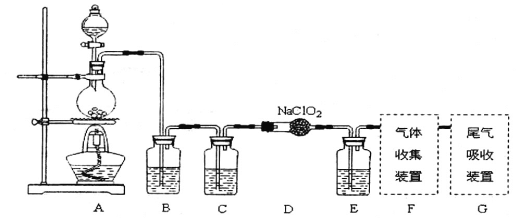
(1)烧瓶内可发生的反应的化学方程式:______________。
(2)B、C、E装置中的试剂依次为____________________
a、NaOH溶液 b、浓硫酸 c、饱和食盐水 d、CCl4 e、饱和石灰水
(3)以下装置既能吸收尾气又能防止倒吸的是_____________
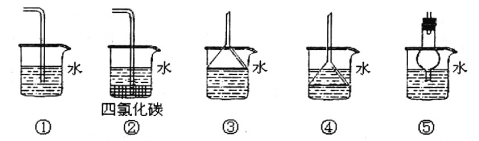
II.用C1O2处理后的自来水中,C1O2的浓度应在0.10~0.80mg·L-1之间。用碘量法检测水中C1O2浓度的实验步骤如下:取100mCL的水样加稀硫酸调节pH至1~3,加入一定量的碘化钾溶液,振荡,再加入少量指示剂后,用1.0×10-4mol·L-1的Na2S2O3溶液滴定(己知:2S2O32-+I2==S4O62-+2I-)。
(4)加入的指示剂是___________,达到滴定终点时的现象是_________;
(5)碘化钾反应的离子方程式是________________。
(6)已知滴定终点时,消耗Na2S2O3溶液16.30mL,则水样中C1O2的浓度是___________mg·L-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com