
【题目】I.已知C1O2是易溶于水难溶于有机溶剂的气体,常用于自来水消毒。实验室制备C1O2是用亚氯酸钠固体与氯气反应:2NaClO2+C12==2C1O2+2NaCl,装置如下图所示:
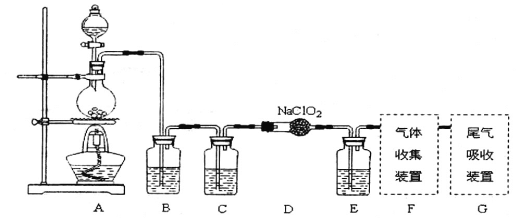
(1)烧瓶内可发生的反应的化学方程式:______________。
(2)B、C、E装置中的试剂依次为____________________
a、NaOH溶液 b、浓硫酸 c、饱和食盐水 d、CCl4 e、饱和石灰水
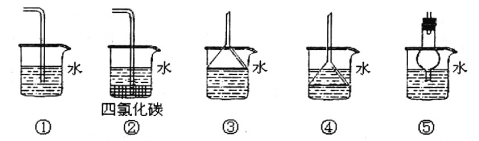
(3)以下装置既能吸收尾气又能防止倒吸的是_____________
II.用C1O2处理后的自来水中,C1O2的浓度应在0.10~0.80mg·L-1之间。用碘量法检测水中C1O2浓度的实验步骤如下:取100mCL的水样加稀硫酸调节pH至1~3,加入一定量的碘化钾溶液,振荡,再加入少量指示剂后,用1.0×10-4mol·L-1的Na2S2O3溶液滴定(己知:2S2O32-+I2==S4O62-+2I-)。
(4)加入的指示剂是___________,达到滴定终点时的现象是_________;
(5)碘化钾反应的离子方程式是________________。
(6)已知滴定终点时,消耗Na2S2O3溶液16.30mL,则水样中C1O2的浓度是___________mg·L-1。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2Oc b d②③⑤淀粉溶液,滴入最后一滴Na2S2O3溶液后,溶液的蓝色变为无色(或蓝色褪去),半分钟内不恢复原来的颜色。2ClO2 +8H++ 10I- = 2Cl- +4H2O +5I20.22
MnCl2+Cl2↑+2H2Oc b d②③⑤淀粉溶液,滴入最后一滴Na2S2O3溶液后,溶液的蓝色变为无色(或蓝色褪去),半分钟内不恢复原来的颜色。2ClO2 +8H++ 10I- = 2Cl- +4H2O +5I20.22
【解析】
(1)由实验装置图可见,烧瓶内制取氯气;(2)饱和食盐水可以吸收挥发出来的氯化氢气体,浓硫酸可以干燥氯气,CCl4可以吸收未参加反应的氯气;(3)ClO2是一种易溶于水的气体,尾气吸收时要防止倒吸,导气管不能插入到液面以下,装置①④可以引起倒吸,②③⑤既能吸收尾气又能防止倒吸;(4)淀粉溶液可以检验氧化生成的单质碘,达到滴定终点时的现象是滴入最后一滴Na2S2O3溶液后,溶液的蓝色变为无色(或蓝色褪去),半分钟内不恢复原来的颜色;(5)二氧化氯将碘离子氧化生成单质碘,根据得失电子和原子个数守恒书写和配平反应的离子方程式;(6)依据方程式得到物质间量的关系:ClO2——5S2O32-,在此基础上建立求解关系式求解。
I.(1)由实验装置图可见,烧瓶内制取氯气,发生的反应的化学方程式:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。(2)B装置用于吸收挥发出来的氯化氢气体,瓶内的试剂是c(饱和食盐水),C装置用于干燥氯气,瓶内的试剂是b(浓硫酸),E装置用于吸收未参加反应的氯气,试剂是d(CCl4)。(3)ClO2是一种易溶于水的气体,尾气吸收时要防止倒吸,导气管不能插入到液面以下,装置①④可以引起倒吸,②③⑤既能吸收尾气又能防止倒吸。II.(4)检验氧化生成的单质碘,加入的指示剂是淀粉溶液,达到滴定终点时的现象是滴入最后一滴Na2S2O3溶液后,溶液的蓝色变为无色(或蓝色褪去),半分钟内不恢复原来的颜色。(5)二氧化氯将碘离子氧化生成单质碘,根据得失电子平衡,反应的离子方程式是:2ClO2+8H++10I-=2Cl-+4H2O+5I2。(6)依据方程式2ClO2+8H++10I-=2Cl-+4H2O+5I2和2S2O32-+I2=S4O62-+2I-可得ClO2——5S2O32-,则有
MnCl2+Cl2↑+2H2O。(2)B装置用于吸收挥发出来的氯化氢气体,瓶内的试剂是c(饱和食盐水),C装置用于干燥氯气,瓶内的试剂是b(浓硫酸),E装置用于吸收未参加反应的氯气,试剂是d(CCl4)。(3)ClO2是一种易溶于水的气体,尾气吸收时要防止倒吸,导气管不能插入到液面以下,装置①④可以引起倒吸,②③⑤既能吸收尾气又能防止倒吸。II.(4)检验氧化生成的单质碘,加入的指示剂是淀粉溶液,达到滴定终点时的现象是滴入最后一滴Na2S2O3溶液后,溶液的蓝色变为无色(或蓝色褪去),半分钟内不恢复原来的颜色。(5)二氧化氯将碘离子氧化生成单质碘,根据得失电子平衡,反应的离子方程式是:2ClO2+8H++10I-=2Cl-+4H2O+5I2。(6)依据方程式2ClO2+8H++10I-=2Cl-+4H2O+5I2和2S2O32-+I2=S4O62-+2I-可得ClO2——5S2O32-,则有![]() =
=![]() ,解得x=3.26×10-4mmol,则水样中C1O2的浓度是3.26×10-4mmol×10×67.5=0.22mg·L-1。
,解得x=3.26×10-4mmol,则水样中C1O2的浓度是3.26×10-4mmol×10×67.5=0.22mg·L-1。


 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】室温下,将1mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2;CuSO4·5H2O受热分解的化学方程式为:CuSO4·5H2O(s)△CuSO4(s)+5H2O(l), 热效应为△H3。则下列判断正确的是
A. △H2>△H3 B. △H1<△H3
C. △H1+△H3=△H2 D. △H1+△H2>△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学概念从一提出来,就明确了它的目标是研究和寻找能充分利用的无毒害原材料,最大限度地节约能源,在化工生产各环节都实现净化和无污染的反应途径。下列化工生产中体现绿色化学内涵的是( )。
①减少“三废”排放量
②考虑有关原材料的再生利用
③出现污染问题再治理
④回收未反应的原料、副产物、助溶剂、稳定剂等非反应试剂
⑤拒绝使用无法替代、无法回收、无法再生和重复使用的有毒副作用、污染明显的原料
A.①③④ B.①②③⑤ C.①②④⑤ D.②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数。下列说法正确的是( )
A. 286g Na2CO3·10H2O晶体中CO32-数目等于0.1NA
B. 标准状况下,4.48L NO和2.24L O2完全反应后,容器内气体分子数为0.2NA
C. 0.1mol Na和氧气在一定条件下反应生成3.5g氧化物时,失去的电子数为0.2NA
D. 含有1mol FeCl3的饱和溶液滴入沸腾蒸馏水中,所得红褐色液体中含胶粒数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积可变的密闭容器中加入WO3和H2进行反应WO3(s)+3H2(g)![]() W(s)+3H2O(g),下列说法不正确的是
W(s)+3H2O(g),下列说法不正确的是
A. 增加H2O(g)的量,消耗H2的速率瞬间不变
B. 将容器的体积缩小一半,其反应速率加快
C. 保持体积不变,充入氩气,其反应速率不变
D. 保持压强不变,充入氖气,H2O(g)生成速率减慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下在容积为2 L的密闭容器内进行某一反应,容器内气体X、气体Y的物质的量随反应时间变化的曲线如图所示。据图可知

A. 反应的化学方程式为4Y=X
B. 反应进行到t1时,Y的浓度减少了3 mol·L-1
C. 反应进行到t2时,达到平衡状态
D. 反应进行到t3时,每生成4 mol Y的同时生成1 mol X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质能满足如图所示转化关系的是(图中箭头表示进一步转化)
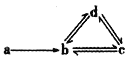
a | b | c | d | |
① | Si | SiO2 | H2SiO3 | Na2SiO3 |
② | Al | AlCl3 | NaAlO2 | Al(OH)3 |
③ | Cu | CuO | Cu(OH)2 | CuSO4 |
④ | Fe2O3 | FeCl3 | FeCl2 | Fe |
A. ①② B. ②③ C. ③④ D. ②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】榴石矿石可以看作CaO、FeO、Fe2O3、Al2O3、SiO2组成。工业上对其进行综合利用的流程如下:
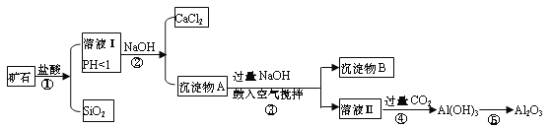
(1)用方程式表示盛放氢氧化钠溶液的试剂瓶不能用玻璃塞的原因________;
(2)溶液Ⅰ中除了Ca2+外,还可能含有的金属阳离子有_______________;
(3)步骤③中NaOH参加反应的离子方程式是________________,鼓入空气并充分搅拌的目的是_____________________。
(4)在工业生产中,步骤④通入过量CO2而不加入盐酸的原因是___________;写出步骤④通入过量CO2的离子方程式 _________________________________。
(5)试设计实验证明榴石矿中含有FeO(试剂任选,说明实验操作与现象)_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com